Лепка зверей из пластилина: Животные из пластилина: больше 50 мастер-классов
Звери из пластилина для детей с пошаговыми фото
Пластилин — это просто невообразимая находка, ведь он позволяет заниматься с детьми творчеством. Развивает моторику, сенсорные навыки и способности, ну и самое главное — дает место для реализации фантазий малыша. К примеру, звери из пластилина будут интересны как совсем маленькому ребенку, только начинающему осваивать лепку, так и детям постарше.
Пластилиновый возраст
Так как мамы не хотят пропустить момент, когда пора начинать заниматься развитием малыша, они могут пробовать предлагать ребенку пластилин еще в совсем пеленочном возрасте. Но это будет в корне неверно, так как когда ребенок не осознает, что у него в руках, единственное, что он захочет сделать с полученной массой — это попробовать ее на вкус. Поэтому для более младших детей лучше делать массу мучной и соленой. Это оттолкнет желание малыша ее есть.
Если вашему ребенку уже исполнилось два года, то можете смело знакомить его с пластилином.
Такой пластилин может долго храниться, но для хранения следует использовать закрытые контейнеры. Успеет подсохнуть – можно просто размочить его водой.
Начиная с трехлетнего возраста, дети могут уже осилить любой пластилин, для игры с ним можно уже использовать инструменты – стеки, досточки и так далее. Для таких занятий хорошо иметь большую плоскую доску и хотя бы минимальный набор инструментов. Доска предостережет вас он распространения пластилина по всему дому и вещам, рабочее место даже ребенка ненавязчиво приучает к дисциплине.
Расскажем, как пошагово лепить различных животных из пластилина.
Мир животных
Начнем с представителя морских просторов, кроме того, что морские жители легко лепятся, они еще и очень необычные. Например, вот такой краб, как на фото.
Сначала делаются отдельные заготовки: тело, клешни, длинные лапки. На шарик для тела надо надавить один раз, что сделает его приплюснутым. Заготовки для лапок сделать немного полукруглыми. Лапки крепятся равномерно со всех сторон. На две передние накладываются клешни. Обязательно не забываем про глазки.
На шарик для тела надо надавить один раз, что сделает его приплюснутым. Заготовки для лапок сделать немного полукруглыми. Лапки крепятся равномерно со всех сторон. На две передние накладываются клешни. Обязательно не забываем про глазки.
Дикие, но не менее интересные по своему виду звери также заинтересует детей. Если в реальной жизни такие особи можно увидеть только по телевизору или в зоопарке, то с помощью пластилина ребенок может сделать себе даже ручного льва.
Формируется небольшой шар для головы и еще два маленьких для щек, они сразу скрепляются вместе. Цвет пластилина, как и цвет настоящего хищника, берем желтый, для носа подойдет более темный — коричневый. Глазки обычные – из белого пластилина, зрачок – черная точка. Для туловища скатать большую каплю, в вытянутым кончиком. Для создания львенка нам понадобится спичка, с ее помощью скрепим голову и туловище. Для шикарной гривы катайте много маленьких коричневых шариков и лепите их в разнобой на голову. Лапы сделать с пальцами и присоединить к туловищу.
Очень проста в исполнении змейка. Для ее создания катается колбаска любой длины. А далее просто другим цветом выделяются глаза и окрас.
Для милой пандочки понадобятся всего два цвета белый и черный, также можно дополнить ее веточками бамбука зеленого цвета.
Из этого же сочетание цветов мастерим собаку, выполняя шаг за шагом действия, указанные на фото.
Морская черепаха
Покажем подробно с фото, как сделать позитивную черепаху.
Перед тем как приступать к работе, пластилиновая основа размягчается. Сделаем два кружочка, один из более темного пластилина, другой – салатового.
Темный кружок расплющиваем и соединяем его с коричневой заготовкой, делаем небольшие полосочки, как на фото:
Панцирь делаем также рельефным.
Для головы и конечностей подготавливаются маленькие салатовые шарики.
Им придается немного сплющенная форма, и теперь они готовы к креплению на свои места. На самих конечностях прорисовываем пальчики. На голову крепим глазки и делаем нашей черепахе обаятельную улыбку.
На самих конечностях прорисовываем пальчики. На голову крепим глазки и делаем нашей черепахе обаятельную улыбку.
Милый енот
Животные лепятся довольно просто, а получается очень забавно. Вы можете просто показывать ребенку фото, немного подсказок, и он сам сможет сделать на первый взгляд сложную, но на самом деле простую фигурку. Лепим три круглые заготовки.
Крупный шар разделяем еще на несколько.
Начнем с мордочки, на один из подготовленных выше серых кругов лепим белую основу, из которой формируем нос. Для повторения оригинального окраса добавим темные лепешки.
Из маленьких треугольников делаем уши. И добавляем глаза.
Из черной точки делаем кончик носа.
Хвост делаем, раскрашивая одну толстенькую колбаску всем нашим серо-бело-черным набором цветов.
К нему добавляем колбаску поменьше в виде тела.
Всю получившуюся установки ставим на лапки.
Ну и последний штрих – крепим голову. Для большей надежности ее можно укрепить кусочком спички, который вставится в туловище и крепче удержит голову.
Для большей надежности ее можно укрепить кусочком спички, который вставится в туловище и крепче удержит голову.
Видео по теме статьи
Самые лучшие посты
Как слепить из пластилина животных? Инструкции, схемы :: SYL.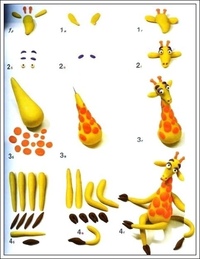 ru
ru
Лепка из пластилина — довольно увлекательное занятие не только для детей, но и для взрослых. В данной статье будет рассмотрено, как слепить из пластилина животных. Ведь именно они наиболее часто изображаются таким способом. Пластилин — это отличный материал для развития ребенка. Именно поэтому работа с ним включена в программы детских садов и школ. Такие занятия развивают не только восприятие цвета и ощущение композиции в пространстве, но и мелкую моторику рук. Дети очень любят поделки из пластилина. Животных, как и сказочных героев, лепят с наибольшим удовольствием.
Как правильно выбрать пластилин
Пластилин пластилину рознь. Для того чтобы процесс работы доставлял только удовольствие, нужно выбрать пластилин правильно. Если вы будете заниматься лепкой с детьми, то лучше выбирать заменитель пластилина. Это специальная масса для лепки, которую не нужно разминать перед использованием. А также она имеет приятные фруктовые запахи. Эта масса совершенно неспособна нанести вред ребенку, даже если он решит ее пожевать.
Что понадобится для работы
Кроме самого пластилина и собственных пальцев, вам также понадобятся некоторые инструменты, такие как доска для лепки, специальный нож, а также каталка для раскатывания пластилина. Еще вам помогут в этом деле стеки. Они представляют собой специальные пластиковые ножи, с помощью которых можно не только разрезать пластилиновую массу, но также приминать ее или создавать на поверхности выемки и вмятины различной формы. Также вам понадобятся спички или зубочистки для соединения отдельных деталей между собой. Кроме всего прочего, пригодятся влажные салфетки для очищения рук в процессе работы, а еще схема лепки животных из пластилина, которая поэтапно поясняет весь процесс, инструкция или мастер-класс. Руководствуясь таким материалом, можно без труда освоить весь процесс лепки животного, как дикого, так и домашнего.
Кроме всего прочего, пригодятся влажные салфетки для очищения рук в процессе работы, а еще схема лепки животных из пластилина, которая поэтапно поясняет весь процесс, инструкция или мастер-класс. Руководствуясь таким материалом, можно без труда освоить весь процесс лепки животного, как дикого, так и домашнего.
Основные приемы работы с пластилином
Лепка животных из пластилина — это процесс поэтапный. Существуют основные фигуры, которые и служат основой для создания различных элементов.
Таковыми являются шар, куб, пирамидка, лепешка, капля и полоса. Куб формируют из шарика, сдавливая и прижимая его с четырех сторон, а затем его можно раскатать, используя для этого скалку, или оставить в форме кубика, выровняв окончательно края плоской палочкой. Или, например, форма «капля» также создается из шарика. В этом случае круглую заготовку с одного края начинают постепенно сжимать и вытягивать до нужной величины.Подготовка к лепке
Прежде чем начать изучать, как слепить из пластилина животных, следует позаботиться о подготовке рабочего места. Поверхность стола, за которым будет производиться лепка, должна хорошо освещаться. Кроме того, следует защитить рабочее место от пластилина. Именно для таких целей и служат специальные досочки. Но если у вас такой нет, то можете просто застелить стол отрезом клеенки, чтобы не запачкать. Для малышей можно запастись различными фигурными формочками, и тогда лепка животных из пластилина станет еще более увлекательным занятием. Также можно приобрести специальные перчатки для ручек, чтобы пластилин в процессе работы не втирался в кожу.
Поверхность стола, за которым будет производиться лепка, должна хорошо освещаться. Кроме того, следует защитить рабочее место от пластилина. Именно для таких целей и служат специальные досочки. Но если у вас такой нет, то можете просто застелить стол отрезом клеенки, чтобы не запачкать. Для малышей можно запастись различными фигурными формочками, и тогда лепка животных из пластилина станет еще более увлекательным занятием. Также можно приобрести специальные перчатки для ручек, чтобы пластилин в процессе работы не втирался в кожу.
Домашние животные из пластилина
Для того чтобы приступить к лепке животных, нужно прежде всего определиться с тем, какого зверя хочется изобразить.
Постарайтесь четко представлять образ, который будет воплощаться при помощи пластилина. Детки, как правило, выбирают для лепки домашних животных. Это связано с тем, что видят они их достаточно часто, в отличие от диких. Обычно любое животное начинают лепить с головы. Для ее создания необходим один крупный шарик для основы и два поменьше — для ушек. Далее из этих шариков создается уже необходимая форма.
Далее из этих шариков создается уже необходимая форма.Также важным является размещение глаз. Они должны быть расположены так, чтобы животное смотрело прямо на вас. Также заготавливаются шарики для туловища, лап и хвоста, если, конечно, таковой имеется. Важным моментом будет соединение всех элементов в одно целое. Для этого можно использовать спички или зубочистки. Если использовать для лепки пластилин средней мягкости, то можно впоследствии играть с этими животными, создавая различные сюжетные линии с участием домашних питомцев.
Дикие животные из пластилина
Мир дикой природы прекрасен. Он наполнен тайнами и загадками. Дети тянутся к загадочному и неизведанному, а значит, их наверняка заинтересует, как слепить из пластилина животных из дикого мира.
 Процесс лепки представителей дикой природы, по сути, ничем не отличается от такового при создании домашних питомцев. Дикие животные из пластилина необязательно должны быть точной копией своих прототипов.Проявляя фантазию и используя различные виды пластилина, например, с блестками, можно создать действительно сказочных существ. Также можно добавлять к процессу природные материалы. Таким образом, процесс изучения диких животных проходит достаточно увлекательно. А из получившихся у вас обитателей лесов, пустынь и гор можно собрать целый зоопарк для игры.
Процесс лепки представителей дикой природы, по сути, ничем не отличается от такового при создании домашних питомцев. Дикие животные из пластилина необязательно должны быть точной копией своих прототипов.Проявляя фантазию и используя различные виды пластилина, например, с блестками, можно создать действительно сказочных существ. Также можно добавлять к процессу природные материалы. Таким образом, процесс изучения диких животных проходит достаточно увлекательно. А из получившихся у вас обитателей лесов, пустынь и гор можно собрать целый зоопарк для игры.Лепка и возраст
В каком же возрасте можно начинать лепить из пластилина? Уже в полтора года можете дать малышу шарик и показать, как его разминать. Конечно, желать, чтобы ребенок слепил в этом возрасте слона или корову, бессмысленно, но он может делать простые заготовки, которые вы уже соберете для него в то или иное животное. В возрасте трех-пяти лет детки уже способны создавать простые фигурки зверей и птиц самостоятельно. А в шесть лет ребенок может лепить более сложные варианты, руководствуясь схемами или мастер-классами.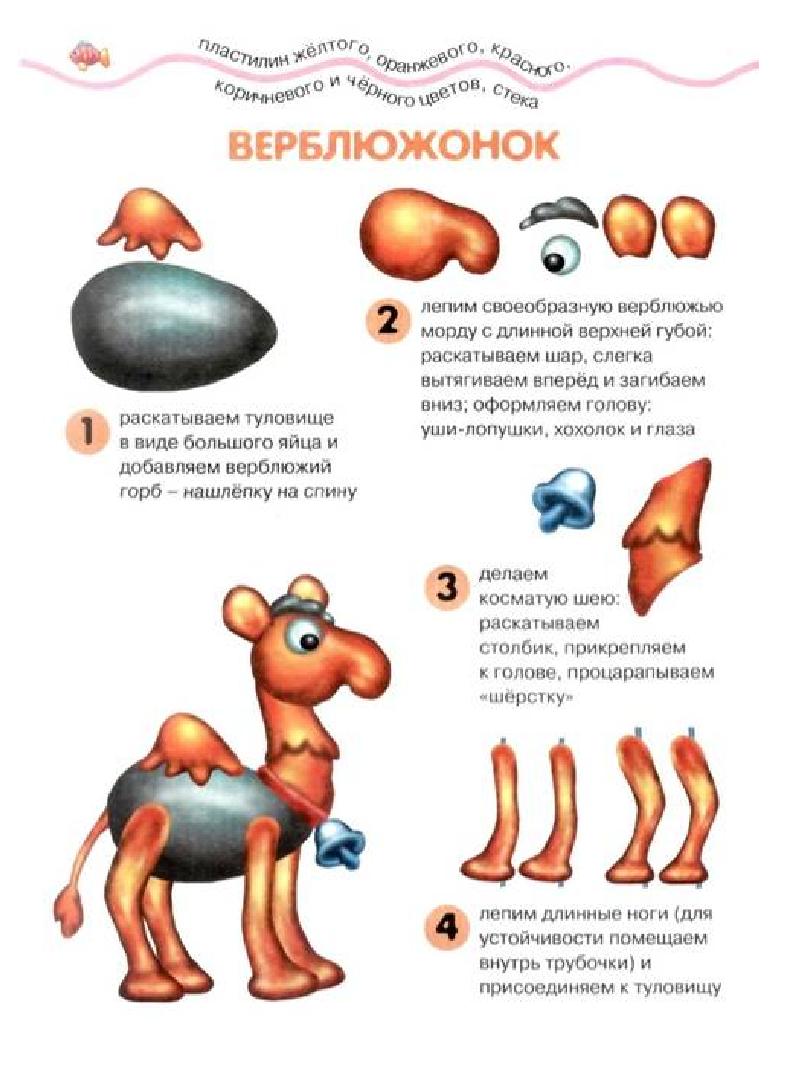 Кроме того, в этом возрасте он уже вовсю подключает к процессу свою фантазию.
Кроме того, в этом возрасте он уже вовсю подключает к процессу свою фантазию.
Как видите, разобраться в том, как слепить из пластилина животных, вовсе не сложно. Главное, не бояться использовать различные материалы и собственную фантазию. А также следовать схеме или инструкции по созданию различных зверюшек. Любой ребенок с удовольствием разделит с вами это увлекательное занятие, и вы сможете создать огромный зоопарк или целую ферму для игр.
Как лепить из пластилина животных: основы для малышей
Пластилин — это очень удобный материал для уроков лепки с детьми. Кроме того, с его помощью можно развивать мелкую моторику ребенка. На сегодняшний день существуют самые разнообразные виды пластилина. Например, популярным набором считается Play-doh. Он очень мягкий, идеально подходит для малышей, но имеет высокую стоимость. Для лепки можно использовать хороший пластилин фирмы Луч, который тоже достаточно мягкий.
Как научить малыша лепить из пластилина?
Лепка из пластилина — одно из самых приятных занятий для ребенка. Вряд ли это суждение будет кто-то оспаривать. До начала занятий необходимо приобрести пластиковую доску, на которой малыш будет лепить. Иногда вместе с доской могут продавать и наборы с формами в виде птиц, животных и т.д.
Вряд ли это суждение будет кто-то оспаривать. До начала занятий необходимо приобрести пластиковую доску, на которой малыш будет лепить. Иногда вместе с доской могут продавать и наборы с формами в виде птиц, животных и т.д.
Затем надо научить малыша правильно лепить из пластилина: показать ему элементарные основы, как катать шарики и палочки. Далее задания можно усложнять. Изучив простые основы, дети смогут лепить из пластилина более сложные фигуры и предметы. Но главное в таком занятии — это практика. С ребенком нужно постоянно что-то лепить, чтобы он смог полноценно развивать и демонстрировать свои творческие способности. Перед началом занятия пластилин надо размять и согреть в руках. Только после этого он станет настолько мягким, что малышу будет легко с ним работать.
В процессе лепки надо постоянно координировать действия малыша, подсказывать ему, как правильно делается та или иная фигура. Если ребенок маленький, нужно еще и следить, чтобы он не брал пластилин в рот. А после окончания занятия необходимо обязательно помыть руки с мылом и вытереть их сухой тряпкой.
А после окончания занятия необходимо обязательно помыть руки с мылом и вытереть их сухой тряпкой.
Чтобы ребенок приобрел определенные навыки, после занятия надо поспрашивать у него, кого он лепил и каким образом это делал. Также нужно закрепить основные знания о том, какие формы, размеры и цвета были использованы и почему. Даже если малыш отвечает не на все вопросы, его обязательно нужно похвалить, чтобы ему захотелось поработать с пластилином еще.
Начинать использовать этот материал для лепки можно примерно в возрасте 1,5-2 года. В это время малышу можно давать маленький кусочек пластилина, чтобы он разминал его пальчиками и выполнял самые простые действия: лепил колбаски и раскатывал лепешки. Дети 3-5 лет уже умеют сами создавать различные фигурки и поделки из пластилина — игрушки, птичек, зверей и т.д. А в возрасте 6-7 лет они могут лепить сложные фигуры, используя в качестве примера фото готовой пластилиновой поделки.
Зверюшки из пластилина
Малыши очень любят лепить из пластилина животных, поскольку зверюшки всегда были и будут их любимыми героями. Как правило, они выбирают любимого зверька из мультфильмов, сказок и рассказов. Поделки из этого материала помогают развиваться малышу, расширяют его понимание форм, сочетания цветовой гаммы, учат его наблюдать за миром живых существ. Ведь для того, чтобы слепить собаку или кошку, белку или лису, нужно вспомнить, как они выглядят, какая у них шерсть, какого цвета и много других тонкостей.
Как правило, они выбирают любимого зверька из мультфильмов, сказок и рассказов. Поделки из этого материала помогают развиваться малышу, расширяют его понимание форм, сочетания цветовой гаммы, учат его наблюдать за миром живых существ. Ведь для того, чтобы слепить собаку или кошку, белку или лису, нужно вспомнить, как они выглядят, какая у них шерсть, какого цвета и много других тонкостей.
Перед началом занятия у малыша должны быть все приспособления, которые могут понадобиться в процессе работы. Итак, чтобы слепить какую-то зверюшку, сначала надо определиться, кто это будет. Выбирать нужно такого зверька, которого ребенок видел и точно знает, как он выглядит. Как правило, малыши выбирают либо домашних зверей, либо тех, которых они видели по телевизору. Например, бегемота. Для его лепки понадобится пластилин (черный, серый и белый), зубочистки и стека.
Любая фигурка животного всегда должна лепиться с головы. Чтобы сделать голову бегемота, понадобится 4 круглых шарика: 2 больших — для головы, 2 маленьких — для ушей и еще 2 маленьких — для глаз. Глаза необходимо размещать так, чтобы бегемот смотрел прямо на вас. Для зубов бегемота понадобится белый пластилин. Туловище зверя нужно сделать из одного большого шарика, а шею — из шарика чуть меньших размеров. Самое важное задание — это соединить все части бегемота вместе. Для этого надо воспользоваться зубочистками. В качестве ног зверька можно сделать 4 шарика средних размеров, а в качестве хвоста — маленький кусочек. Когда все детали будут собраны, получится замечательный бегемотик.
Глаза необходимо размещать так, чтобы бегемот смотрел прямо на вас. Для зубов бегемота понадобится белый пластилин. Туловище зверя нужно сделать из одного большого шарика, а шею — из шарика чуть меньших размеров. Самое важное задание — это соединить все части бегемота вместе. Для этого надо воспользоваться зубочистками. В качестве ног зверька можно сделать 4 шарика средних размеров, а в качестве хвоста — маленький кусочек. Когда все детали будут собраны, получится замечательный бегемотик.
Еще один вариант для лепки — лошадка. Чтобы ее слепить, надо напомнить малышу, из каких частей она состоит. Для изготовления лошадки понадобится слепить ее туловище, голову, 4 ноги и хвост. Туловище лошадки можно сделать, раскатав колбаской, а голову — шариком, который под конец надо вытянуть пальцами. Ноги тоже раскатываются колбаской и присоединяются к туловищу. Гриву и хвост можно сделать из шерстяных ниток, а можно просто придать им нужную форму соответствующими надрезами стекой. Глаза, ноздри и рот лошадки рисуются с помощью зубочистки. Соединяются все детали тоже зубочистками.
Глаза, ноздри и рот лошадки рисуются с помощью зубочистки. Соединяются все детали тоже зубочистками.
Смешарики из пластилина
Кроме того, современным детям очень нравятся главные герои мультфильма «Смешарики». Поскольку их несколько, сначала малышу нужно определиться, кого именно он будет лепить. Чтобы было проще, можно найти картинки или поэтапные схемы выбранного смешарика.
Итак, чтобы сделать пластилинового смешарика, понадобятся стандартные инструменты — пластилин, стека и зубочистки. Перед началом работы материал необходимо немного размять, чтобы он не трескался.
К примеру, можно слепить Лосяша. В качестве головы этого смешарика будет использоваться большой шарик. Рога делаются из 2 кусочков пластилина (коричневого цвета). Первый кусочек надо раскатать колбаской и прикрепить к голове персонажа, а второй будет использоваться в качестве ветки рогов Лосяша. Далее необходимо сделать уши, руки и ноги смешарика. Уши изготавливаются с помощью раскатанных шариков, а руки и ноги — с помощью колбаски. Все части тела прикрепляются к голове зубочистками.
Все части тела прикрепляются к голове зубочистками.
Чтобы Лосяш не скучал в одиночестве, ему можно слепить зайца Кроша. Для этого понадобится пластилин черного, белого, синего, голубого и розового цветов. Для тела смешарика будет использоваться большой голубой шарик, для лапок — 4 шарика поменьше, для хвостика — один маленький шарик, а для ушей — еще 2 голубых (их надо раскатать колбаской). Брови зайчика необходимо оформить синим пластилином, глаза — 2 круглыми белыми блинчиками с черными точками, нос — розовым шариком, зубы — 2 белыми прямоугольниками.
Пошаговая инструкция для лепки кошки из пластилина
При изготовлении поделок из пластилина можно использовать поэтапные инструкции и схемы. Например, можно слепить кошечку.
Сначала необходимо скатать один большой шарик из белого пластилина для туловища, второй шарик поменьше — для головы, а третий шарик, еще меньше, — для хвоста. Смастерить уши и усы кошки можно с помощью 2 маленьких белых шариков, а подушечки на лапах — из 12 белых шариков. Для глаз понадобятся шарики зеленого и черного цвета, а для носа и улыбки — розового цвета.
Для глаз понадобятся шарики зеленого и черного цвета, а для носа и улыбки — розового цвета.
Розовый шарик нужно разделить на 2 части: из одной части скатывается шарик для носа, из второй — делается валик в форме улыбки. В зеленых шариках надо сделать углубления стержнем шариковой ручки и вставить в них шарики черного цвета. Это будут глаза кошки. Кроме того, можно сделать глаза и миндалевидной формы. Для этого зеленым шарикам надо придать соответствующую форму, а черные раскатать колбаской и вертикально прикрепить к зеленым заготовкам.
Для усов нужно раскатать шарик в тонкий валик, а затем разделить его на 6 частей. После этого необходимо соединить полученные детали — прикрепить усы к голове (по три с каждой стороны), а также уши и улыбку. Вокруг усов можно наколоть зубочисткой дырочки.
Далее нужно взять большой шарик для туловища, скатать его колбаской и немного надрезать с обеих сторон. Из надрезанных частей туловища получится 4 валика (лапки). Сгибать их можно произвольным образом.
Если кошка будет пятнистой, то пятна можно сделать из расплющенных кусков оранжевого и коричневого пластилина. В качестве носа будет использоваться розовый треугольный кусочек пластилина.
Далее нужно скатать валик для хвоста, изогнуть его и прикрепить к туловищу с помощью зубочистки. Также присоединяется и голова. Осталось только прилепить к лапам кошки белые подушечки — по три шарика на каждую лапу. Кошечка готова. Ее можно поставить на полку или использовать в качестве игрушки для малышей.
[Полный текст] Модели на животных и терапевтические молекулярные мишени рака: полезность и
Департамент клинических наук о мелких животных, Колледж ветеринарной медицины, Университет Теннесси, Ноксвилл, Теннесси, США
Резюме: Рак — это термин используется для описания более 100 заболеваний, имеющих несколько общих признаков. Несмотря на профилактику, раннее выявление и новые методы лечения, рак по-прежнему остается второй ведущей причиной смерти в США. Успешный практический перевод основных научных данных о раке в терапевтические вмешательства для пациентов зависит от выбора подходящих экспериментальных моделей на животных.В исследованиях рака in vitro используются линии раковых клеток человека и животных для изучения биохимических путей в этих раковых клетках. В этом обзоре мы обобщаем важные модели рака на животных с акцентом на их преимущества и недостатки. Мышиные модели рака хорошо известны и часто используются для исследований рака. Модели на грызунах революционизировали нашу способность изучать функции генов и белков in vivo и лучше понимать их молекулярные пути и механизмы. Ксенотрансплантат и химически или генетически индуцированный рак мышей являются наиболее часто используемыми моделями рака у грызунов.Животные-компаньоны со спонтанными новообразованиями по-прежнему являются малоизвестным инструментом для быстрого прогресса в лечении рака человека и ветеринарии путем тестирования новых лекарств и систем доставки, которые показали себя многообещающими in vitro и in vivo на моделях мышей.
Несмотря на профилактику, раннее выявление и новые методы лечения, рак по-прежнему остается второй ведущей причиной смерти в США. Успешный практический перевод основных научных данных о раке в терапевтические вмешательства для пациентов зависит от выбора подходящих экспериментальных моделей на животных.В исследованиях рака in vitro используются линии раковых клеток человека и животных для изучения биохимических путей в этих раковых клетках. В этом обзоре мы обобщаем важные модели рака на животных с акцентом на их преимущества и недостатки. Мышиные модели рака хорошо известны и часто используются для исследований рака. Модели на грызунах революционизировали нашу способность изучать функции генов и белков in vivo и лучше понимать их молекулярные пути и механизмы. Ксенотрансплантат и химически или генетически индуцированный рак мышей являются наиболее часто используемыми моделями рака у грызунов.Животные-компаньоны со спонтанными новообразованиями по-прежнему являются малоизвестным инструментом для быстрого прогресса в лечении рака человека и ветеринарии путем тестирования новых лекарств и систем доставки, которые показали себя многообещающими in vitro и in vivo на моделях мышей. Животные-компаньоны имеют относительно высокую заболеваемость раком, их биологическое поведение, реакция на терапию и реакция на цитотоксические агенты аналогичны таковым у людей. Более короткая общая продолжительность жизни и более быстрое прогрессирование заболевания — факторы, способствующие преимуществам модели животного-компаньона.Кроме того, в настоящее время основное внимание уделяется обнаружению молекулярных мишеней для новых терапевтических препаратов для улучшения выживаемости и качества жизни онкологических больных.
Животные-компаньоны имеют относительно высокую заболеваемость раком, их биологическое поведение, реакция на терапию и реакция на цитотоксические агенты аналогичны таковым у людей. Более короткая общая продолжительность жизни и более быстрое прогрессирование заболевания — факторы, способствующие преимуществам модели животного-компаньона.Кроме того, в настоящее время основное внимание уделяется обнаружению молекулярных мишеней для новых терапевтических препаратов для улучшения выживаемости и качества жизни онкологических больных.
Ключевые слова: модель рака у мышей , модель рака у домашних животных, собаки, кошки, молекулярные мишени
Введение
Рак характеризовался несколькими отличительными чертами во время своего многоступенчатого развития: поддержание пролиферативной передачи сигналов, уклонение от подавителей роста, обеспечение репликативного бессмертия, сопротивление гибели клеток, опухолевое воспаление, индукция ангиогенеза, активация инвазии и метастазирования, нестабильность и мутации генома, избегание иммунной деструкции и дерегуляции клеточной энергетики. 1 По данным Американского онкологического общества, рак является второй по частоте причиной смерти в США, уступая только сердечно-сосудистым заболеваниям. 2 Ожидается, что в 2014 году около 585 720 американцев умрут от рака, при этом в 2014 году будет диагностировано почти 1600 человек в день и около 1 665 540 новых случаев рака. Рак обычно обнаруживается, когда произошли структурные изменения в ткани или органе. Пятилетняя относительная выживаемость для всех видов рака, диагностированных в период с 2003 по 2009 год, составляет 68% по сравнению с 49% в 1975–1977 годах. 2 Раннее обнаружение опухолей и точный мониторинг реакции опухоли на лечение являются ключом к выживанию пациентов. Открытие специфичных для опухолей молекулярных мишеней необходимо для улучшения выявления и эффективного лечения рака на ранних стадиях. Таким образом, весьма желательно соответствующее использование и разработка моделей рака in vitro и in vivo.
1 По данным Американского онкологического общества, рак является второй по частоте причиной смерти в США, уступая только сердечно-сосудистым заболеваниям. 2 Ожидается, что в 2014 году около 585 720 американцев умрут от рака, при этом в 2014 году будет диагностировано почти 1600 человек в день и около 1 665 540 новых случаев рака. Рак обычно обнаруживается, когда произошли структурные изменения в ткани или органе. Пятилетняя относительная выживаемость для всех видов рака, диагностированных в период с 2003 по 2009 год, составляет 68% по сравнению с 49% в 1975–1977 годах. 2 Раннее обнаружение опухолей и точный мониторинг реакции опухоли на лечение являются ключом к выживанию пациентов. Открытие специфичных для опухолей молекулярных мишеней необходимо для улучшения выявления и эффективного лечения рака на ранних стадиях. Таким образом, весьма желательно соответствующее использование и разработка моделей рака in vitro и in vivo.
В исследовании рака in vitro используются линии раковых клеток человека и животных для изучения биохимических путей в раковых клетках. 3 Практически все непрерывные линии раковых клеток происходят от злокачественных опухолей высокой степени злокачественности.Использование нормальных клеточных линий стало возможным благодаря иммортализации этих клеток с помощью вирусных векторов. 4,5 На пути к персонализированным протоколам лечения, основанным на генетическом профиле человека, использование первичных линий раковых клеток, полученных от пациентов, вместо общих клеточных линий стало ценной системой in vitro для разработки режимов лечения рака. 6,7 Преимущества моделей рака in vitro — это строго контролируемые условия, однородность, открытие молекулярных механизмов и воспроизводимость.Основными ограничениями двумерных линий раковых клеток в культуре клеток in vitro являются отбор фенотипических и генотипических клеток во время адаптации к условиям in vitro, накопление мутаций в клетках с течением времени в культуре, гомогенная популяция клеток и изоляция клеток от микросреда опухоли.
3 Практически все непрерывные линии раковых клеток происходят от злокачественных опухолей высокой степени злокачественности.Использование нормальных клеточных линий стало возможным благодаря иммортализации этих клеток с помощью вирусных векторов. 4,5 На пути к персонализированным протоколам лечения, основанным на генетическом профиле человека, использование первичных линий раковых клеток, полученных от пациентов, вместо общих клеточных линий стало ценной системой in vitro для разработки режимов лечения рака. 6,7 Преимущества моделей рака in vitro — это строго контролируемые условия, однородность, открытие молекулярных механизмов и воспроизводимость.Основными ограничениями двумерных линий раковых клеток в культуре клеток in vitro являются отбор фенотипических и генотипических клеток во время адаптации к условиям in vitro, накопление мутаций в клетках с течением времени в культуре, гомогенная популяция клеток и изоляция клеток от микросреда опухоли. Имитирующие взаимодействия между опухолевыми клетками и клеточным матриксом, четко определенные трехмерные модели рака in vitro и системы сокультивирования получили признание для широкого круга диагностических и терапевтических приложений. 8,9 Несмотря на все упомянутые недостатки, линии раковых клеток были и будут модельной системой in vitro для исследований рака.
Имитирующие взаимодействия между опухолевыми клетками и клеточным матриксом, четко определенные трехмерные модели рака in vitro и системы сокультивирования получили признание для широкого круга диагностических и терапевтических приложений. 8,9 Несмотря на все упомянутые недостатки, линии раковых клеток были и будут модельной системой in vitro для исследований рака.
Разработка моделей in vivo на животных, которые воспроизводят естественную историю рака человека и их клиническую реакцию на терапию, составляет важную предпосылку для быстрой трансляции экспериментальных противоопухолевых методов лечения и средств визуализации, которые показали себя многообещающими на моделях in vitro ( как показано на рисунке 1).В этом обзоре суммируются преимущества и ограничения моделей рака у животных in vivo с акцентом на ксенотрансплантат и химически или генетически индуцированные мышиные модели рака, а также спонтанно возникающие модели рака у домашних животных. Спонтанные раковые заболевания у домашних собак и кошек предлагают уникальную модель для биологии рака человека и трансляционной терапии рака. 10 Животные-компаньоны имеют относительно высокую заболеваемость раком, их биологическое поведение, реакция на терапию и реакция на цитотоксические агенты аналогичны тем, которые встречаются у людей.Более короткая общая продолжительность жизни и более быстрое прогрессирование заболевания являются дополнительными факторами, способствующими преимуществам модели животного-компаньона. 10–12 Кроме того, мы обсуждаем текущие знания о терапевтических мишенях, которые играют важную роль в онкогенезе человека и животных.
10 Животные-компаньоны имеют относительно высокую заболеваемость раком, их биологическое поведение, реакция на терапию и реакция на цитотоксические агенты аналогичны тем, которые встречаются у людей.Более короткая общая продолжительность жизни и более быстрое прогрессирование заболевания являются дополнительными факторами, способствующими преимуществам модели животного-компаньона. 10–12 Кроме того, мы обсуждаем текущие знания о терапевтических мишенях, которые играют важную роль в онкогенезе человека и животных.
Рис. 1. Важность моделей рака у домашних животных при открытии лекарств для обнаружения и лечения рака. |
Модели рака грызунов
Самая большая проблема, с которой сталкиваются онкологи, — это наше неполное понимание генетической основы сложных заболеваний человека, включая рак. Большая часть исследований в области генетики рака человека проводится на животных моделях. Мышиные модели рака хорошо известны и часто используются в качестве моделей для исследований рака. Мышиные модели революционизировали нашу способность изучать функции генов и белков in vivo и лучше понимать их молекулярные пути и механизмы. 13 Наиболее распространенными моделями рака у грызунов являются ксенотрансплантаты и химически или генетически индуцированный рак. 14
Большая часть исследований в области генетики рака человека проводится на животных моделях. Мышиные модели рака хорошо известны и часто используются в качестве моделей для исследований рака. Мышиные модели революционизировали нашу способность изучать функции генов и белков in vivo и лучше понимать их молекулярные пути и механизмы. 13 Наиболее распространенными моделями рака у грызунов являются ксенотрансплантаты и химически или генетически индуцированный рак. 14
Рак ксенотрансплантата грызунов, модель
В модели рака ксенотрансплантата раковые клетки человека или животных трансплантируют либо под кожу (эктопический), либо в орган опухолевого происхождения (ортотопический) с использованием грызунов с ослабленным иммунитетом. 14–16 Наиболее распространенными типами грызунов с ослабленным иммунитетом, используемых в исследованиях рака, являются бестимусные голые ( Forkhead box protein N1 [ Foxn1 nu ]) мыши и мыши с тяжелым иммунодефицитом (SCID). 17 Бестимусная голая мышь имеет мутацию гена Foxn1 , приводящую к серьезному ослаблению иммунной системы. Грызуны SCID имеют однонуклеотидный полиморфизм в ДНК-зависимой протеинкиназе гена каталитического полипептида ( Prkdc ), что приводит к полному отказу их иммунной системы из-за отсутствия или атипичности Т- и В-лимфоцитов.
17 Бестимусная голая мышь имеет мутацию гена Foxn1 , приводящую к серьезному ослаблению иммунной системы. Грызуны SCID имеют однонуклеотидный полиморфизм в ДНК-зависимой протеинкиназе гена каталитического полипептида ( Prkdc ), что приводит к полному отказу их иммунной системы из-за отсутствия или атипичности Т- и В-лимфоцитов.
Ксенотрансплантатные модели рака животных представляют собой относительно недорогой метод создания опухолей in vivo с использованием линий раковых клеток человека и животных.Эти модели позволяют проводить испытания in vivo и разрабатывать успешные средства лечения рака и визуализации, идентифицированные in vitro. 18,19 Основные недостатки моделей рака грызунов с ксенотрансплантатом, которые ограничивают быстрый перевод исследований в клинику, включают: эффективность конкретных противораковых препаратов только в отношении определенных раковых опухолей, поверхностная васкуляризация опухолей ксенотрансплантата и отсутствие взаимодействий строма-опухоль. Основным ограничением моделей рака ксенотрансплантата является то, что используемые мыши и крысы имеют ослабленную иммунную систему, поэтому они не отражают поведение естественного рака у людей. 18,20
Основным ограничением моделей рака ксенотрансплантата является то, что используемые мыши и крысы имеют ослабленную иммунную систему, поэтому они не отражают поведение естественного рака у людей. 18,20
Химически индуцированные модели рака на грызунах
Химически индуцированные модели рака у грызунов разрабатываются путем воздействия канцерогенов, например, N-бутил-N- (4-гидроксибутил) нитрозамина, 21–24 4- (метилнитрозамино) -1- (3-пиридил) -1- бутанон, 25,26 N-этил-N-нитрозомочевина, 27 азоксиметан, 28,29 бензопирен, 30 уретан, 31 и асбестовые волокна. 32 Модели на грызунах с химически индуцированным раком помогают в изучении сложных признаков рака, но требуют высокопроизводительного секвенирования для выявления мутаций, что делает метод трудоемким и требует много времени.
Генно-инженерные мышиные модели рака
В прошлом, условные и индуцибельные системы использовались для обеспечения тканеспецифической и временной индукции различных онкогенов или подавления генов-супрессоров опухолей, что приводило к развитию спонтанного рака. 33 Наиболее часто используемые системы — это Cre-Lox , 34 тетрациклин-зависимая регуляция промотора, 35 и Flp -опосредованные методы сайт-специфической и спонтанной рекомбинации. 36 Генетически модифицированные мыши создаются путем микроинъекции ДНК в пронуклеусы оплодотворенных зигот, а трансген интегрируется в геном. 37,38 Трансгенные мыши, созданные для переноса клонированных онкогенов 39 и мышей с нокаутом, лишенных генов супрессоров опухолей 40 , предоставили хорошие модели рака человека. Было разработано несколько трансгенных моделей для спорадических видов рака, например, посредством подавления гена Apc в животной модели семейного аденоматозного полипоза человека. 41,42 Эти генно-инженерные модели животных оказали большое влияние на открытие онкологических лекарств и доклиническую трансляционную биологию. 31,43–45 Главный недостаток этих моделей — неспособность контролировать уровень и характер экспрессии генов.
33 Наиболее часто используемые системы — это Cre-Lox , 34 тетрациклин-зависимая регуляция промотора, 35 и Flp -опосредованные методы сайт-специфической и спонтанной рекомбинации. 36 Генетически модифицированные мыши создаются путем микроинъекции ДНК в пронуклеусы оплодотворенных зигот, а трансген интегрируется в геном. 37,38 Трансгенные мыши, созданные для переноса клонированных онкогенов 39 и мышей с нокаутом, лишенных генов супрессоров опухолей 40 , предоставили хорошие модели рака человека. Было разработано несколько трансгенных моделей для спорадических видов рака, например, посредством подавления гена Apc в животной модели семейного аденоматозного полипоза человека. 41,42 Эти генно-инженерные модели животных оказали большое влияние на открытие онкологических лекарств и доклиническую трансляционную биологию. 31,43–45 Главный недостаток этих моделей — неспособность контролировать уровень и характер экспрессии генов. Случайная интеграция трансгена также может привести к неожиданным фенотипам. 13
Случайная интеграция трансгена также может привести к неожиданным фенотипам. 13
Животные-компаньоны
Животные-компаньоны со спонтанными новообразованиями по-прежнему малоизвестны для быстрого прогресса в лечении рака человека и ветеринарии путем тестирования новых соединений и систем доставки, которые показали себя многообещающими in vitro и in vivo на моделях мышей.Модель на мышах имеет несколько преимуществ, включая короткое время беременности, малый размер, относительно недорогое обслуживание и простоту манипуляции с экспрессией генов. 46 Тем не менее, средний показатель успешной трансляции моделей на грызунах в клинические испытания рака составляет менее 8%. 47 Другим серьезным недостатком мышиной модели является то, что мыши могут переносить более высокие концентрации лекарств, чем пациенты-люди, а костный мозг мыши может быть менее чувствителен ко многим цитотоксическим агентам. 48 Учитывая огромные различия видов между мышами и людьми, важно использовать другие животные модели, такие как животные-компаньоны с естественным раком.
Сравнительная онкология объединяет животных-компаньонов с естественным раком для изучения биологии рака. Клинические испытания с животными-компаньонами способствуют развитию у людей, а также онкологии животных, включая тестирование новых диагностических и терапевтических средств, которые принесут пользу как людям, так и домашним животным. В 2014 году в США будет диагностирован рак у 1,6 миллиона человек. 2 Около 6 миллионов собак и такое же количество кошек ежегодно диагностируют рак в США.Эта большая популяция домашних животных, больных раком, дает возможность изучать спонтанные виды рака, подобные тем, которые возникают у людей. 49 Естественные опухоли у собак и кошек имеют больше клинических и биологических сходств с раком человека, чем любая другая модель рака у животных. 46 У собак развиваются опухоли вдвое чаще, чем у людей, а у кошек вдвое реже, чем у людей. 12 Средний возраст собаки, у которой развивается спонтанный рак, составляет 8,4 года, что соответствует среднему возрасту человека в 50 лет, что позволяет предположить, что, как и у людей, на спонтанные раковые заболевания у собак влияют возраст и окружающая среда. 50 Раковые заболевания животных-компаньонов возникают у животных с интактной иммунной системой. Опухоли неоднородны, развиваются рецидивирующее и лекарственно-устойчивое заболевание и метастазируют в отдаленные места. Эти опухоли лучше, чем любая другая модельная система, отражают суть рака человека. 51 Опухоли животных гистологически очень похожи на рак человека и реагируют так же на обычные методы лечения. Значительно более короткий жизненный цикл является важным преимуществом для проведения клинических испытаний, поскольку позволяет более быстро собирать данные о выживаемости. 46 Интервал без признаков заболевания у собак, леченных от рака, составляет 18 месяцев, тогда как для оценки результатов лечения у людей необходимо 7 лет. 50
50 Раковые заболевания животных-компаньонов возникают у животных с интактной иммунной системой. Опухоли неоднородны, развиваются рецидивирующее и лекарственно-устойчивое заболевание и метастазируют в отдаленные места. Эти опухоли лучше, чем любая другая модельная система, отражают суть рака человека. 51 Опухоли животных гистологически очень похожи на рак человека и реагируют так же на обычные методы лечения. Значительно более короткий жизненный цикл является важным преимуществом для проведения клинических испытаний, поскольку позволяет более быстро собирать данные о выживаемости. 46 Интервал без признаков заболевания у собак, леченных от рака, составляет 18 месяцев, тогда как для оценки результатов лечения у людей необходимо 7 лет. 50
Секвенирование генома собак с широким охватом позволило лучше понять генетику рака и провести сравнение у собак и людей. 52 Недавние исследования показали более сильное сходство между геномом собаки и человека по сравнению с геномом мыши. 50 Одни и те же опухолевые онкогены и гены-супрессоры способствуют развитию рака у людей и собак. 50 Гомология последовательностей белков, ассоциированных с раком человека и собак, например p53, Rb, MDM2, BRCA1 и BRCA2, 53,54 , аналогична, как показано в таблице 1. Филогенетическое дерево различных видов рака: родственные гены, включая p53, c-Myc, циклооксигеназу-2 (COX-2) и c-KIT , показывает, что гены собаки и кошки больше похожи на гены человека, чем на гены мыши, как показано на рисунке 2. Существуют сходства в цитогенетических аномалиях рака человека и собак, такие как слияние гена Abl ( тирозинкиназа Абельсона ) с частью гена BCR (область кластера точки разрыва ), что приводит к конститутивному активная тирозинкиназа BCR-Abl при лейкемии, 55 или наличие мутаций c-KIT в опухолях желудочно-кишечного тракта 56 у людей и собак.У собак может развиться широкий спектр видов рака, наиболее распространенными из которых являются лимфома, гемангиосаркома, остеосаркома (OSA), опухоли тучных клеток, меланома, плоскоклеточный рак, рак молочной железы, рак апокринной железы (анальный мешок), переходно-клеточный рак и мягких тканей.
50 Одни и те же опухолевые онкогены и гены-супрессоры способствуют развитию рака у людей и собак. 50 Гомология последовательностей белков, ассоциированных с раком человека и собак, например p53, Rb, MDM2, BRCA1 и BRCA2, 53,54 , аналогична, как показано в таблице 1. Филогенетическое дерево различных видов рака: родственные гены, включая p53, c-Myc, циклооксигеназу-2 (COX-2) и c-KIT , показывает, что гены собаки и кошки больше похожи на гены человека, чем на гены мыши, как показано на рисунке 2. Существуют сходства в цитогенетических аномалиях рака человека и собак, такие как слияние гена Abl ( тирозинкиназа Абельсона ) с частью гена BCR (область кластера точки разрыва ), что приводит к конститутивному активная тирозинкиназа BCR-Abl при лейкемии, 55 или наличие мутаций c-KIT в опухолях желудочно-кишечного тракта 56 у людей и собак.У собак может развиться широкий спектр видов рака, наиболее распространенными из которых являются лимфома, гемангиосаркома, остеосаркома (OSA), опухоли тучных клеток, меланома, плоскоклеточный рак, рак молочной железы, рак апокринной железы (анальный мешок), переходно-клеточный рак и мягких тканей. саркома. 50,57 Несколько типов рака, которые могут быть подходящими моделями для рака человека, а также расчетный процент всех новых видов рака у собак и кошек в США, сведены в Таблицу 2.
саркома. 50,57 Несколько типов рака, которые могут быть подходящими моделями для рака человека, а также расчетный процент всех новых видов рака у собак и кошек в США, сведены в Таблицу 2.
Таблица 1 Список основных молекулярных мишеней с указанием процентной идентичности их последовательностей с белками человека. |
Рисунок 2 Филогенные деревья генов для разных видов. |
Таблица 2 Расчетный процент всех новых случаев рака у собак и кошек в США |
Лимфома
Лимфомы — это лимфоцитарный рак, который может возникать в любом месте, где обнаружены лимфоциты, включая костный мозг, лимфатические узлы, селезенку, кишечник и другие области лимфатической системы. Лейкоз — это рак кроветворных клеток, возникающий в костном мозге. Лейкемии и лимфомы классифицируются в зависимости от типа клеток, которые демонстрируют неконтролируемый рост. По оценкам, 731 277 человек живут с лимфомой или находятся в стадии ремиссии в США, и в 2014 году ожидается около 79 990 новых случаев лимфомы в США. частота неходжкинской лимфомы составляет 83% всех случаев рака кроветворения у собак. 59 Кошачья лимфома составляет 50–90% всех кроветворных опухолей у кошек, а поскольку кроветворные опухоли составляют примерно одну треть всех кошачьих опухолей, по оценкам, 200 на 100 000 кошек подвержены риску. 60 Вирус лейкемии кошек был наиболее частой причиной лимфомы с 1960 по 1980 год, когда примерно две трети случаев лимфомы были связаны с антигенемией вируса лейкемии кошек. 60 Причины лимфомы собак в основном генетические, но также подозреваются факторы окружающей среды, такие как гербициды. 61 Существует сильное сходство между лимфомами собак и человека, включая цитогенетические и клинические особенности, биологию опухоли, поведение опухоли и генетические аберрации, что делает собак важной моделью животных для изучения прогрессирования заболевания и терапевтических возможностей.
Лейкоз — это рак кроветворных клеток, возникающий в костном мозге. Лейкемии и лимфомы классифицируются в зависимости от типа клеток, которые демонстрируют неконтролируемый рост. По оценкам, 731 277 человек живут с лимфомой или находятся в стадии ремиссии в США, и в 2014 году ожидается около 79 990 новых случаев лимфомы в США. частота неходжкинской лимфомы составляет 83% всех случаев рака кроветворения у собак. 59 Кошачья лимфома составляет 50–90% всех кроветворных опухолей у кошек, а поскольку кроветворные опухоли составляют примерно одну треть всех кошачьих опухолей, по оценкам, 200 на 100 000 кошек подвержены риску. 60 Вирус лейкемии кошек был наиболее частой причиной лимфомы с 1960 по 1980 год, когда примерно две трети случаев лимфомы были связаны с антигенемией вируса лейкемии кошек. 60 Причины лимфомы собак в основном генетические, но также подозреваются факторы окружающей среды, такие как гербициды. 61 Существует сильное сходство между лимфомами собак и человека, включая цитогенетические и клинические особенности, биологию опухоли, поведение опухоли и генетические аберрации, что делает собак важной моделью животных для изучения прогрессирования заболевания и терапевтических возможностей. 46,59 Заболеваемость собак неходжкинской лимфомой аналогична таковой у людей: 62 с оценочной популяцией более 75 миллионов собак в группе риска в США. 63 Люди и собаки имеют схожую гистологию неходжкинской лимфомы с диффузными крупными В-клетками и аналогичную схему лечения комбинированной химиотерапией, включая циклофосфамид, доксорубицин, винкристин и преднизон. 64 Лимфомы становятся все более устойчивыми к широко используемым методам лечения, поэтому важно понимать болезнь и открывать новые методы лечения на подходящих моделях животных. Собачьи модели успешно использовались для разработки новых химиотерапевтических стратегий, например, аспарагиназы. 65
46,59 Заболеваемость собак неходжкинской лимфомой аналогична таковой у людей: 62 с оценочной популяцией более 75 миллионов собак в группе риска в США. 63 Люди и собаки имеют схожую гистологию неходжкинской лимфомы с диффузными крупными В-клетками и аналогичную схему лечения комбинированной химиотерапией, включая циклофосфамид, доксорубицин, винкристин и преднизон. 64 Лимфомы становятся все более устойчивыми к широко используемым методам лечения, поэтому важно понимать болезнь и открывать новые методы лечения на подходящих моделях животных. Собачьи модели успешно использовались для разработки новых химиотерапевтических стратегий, например, аспарагиназы. 65
Рак головы и шеи
Раковые образования, возникающие из плоскоклеточных клеток, выстилающих влажные слизистые поверхности внутри головы и шеи, вместе известны как рак головы и шеи (HNC).В 2014 году ожидается около 42 440 новых случаев заболевания HNC. Уровень заболеваемости у мужчин более чем в два раза выше, чем у женщин. 2 HNC агрессивен, местно-инвазивен и часто диагностируется на поздних стадиях своего развития, поэтому современные стратегии лечения, включая хирургическое вмешательство, лучевую терапию и химиотерапию, часто неэффективны для HNC. 66
HNC составляют 20% всех злокачественных новообразований полости рта у собак. 67 Собаки с HNC использовались в качестве экспериментальных моделей для оценки лучевой терапии. 12 Подобно HNC человека, вызванному воздействием табака и инфекцией папилломавируса человека, HNC у домашних животных также были связаны с воздействием табачного дыма из окружающей среды 68 и вирусом папилломы собак и кошек. 69,70 HNC составляют 75% всех опухолей полости рта у кошек. 71,72 Заболеваемость HNC у кошек аналогична таковой у людей, составляя до 10% всех раковых заболеваний у кошек. 73 У кошек рак метастазирует в регионарные лимфатические узлы (14.8–18%) и легких (12%) позже в ходе болезни, и большинство пораженных кошек подвергается эвтаназии из-за низкого качества жизни. 74,75 Вторичный табачный дым 76 и вирус папилломы связаны с кошачьими HNC. 70 HNC как у кошек, так и у собак являются местно-инвазивными, с метастазами и местным рецидивом заболевания. 76 Из-за очень схожих факторов риска рака полости рта у людей, собак и кошек, важно изучить клеточные линии животных-компаньонов с естественным раком, чтобы лучше понять болезнь человека. 7
Рак мочевого пузыря
По данным Американского онкологического общества, рак мочевого пузыря является четвертым по распространенности раком у мужчин и восьмым по частоте злокачественным новообразованием у женщин в США. Ожидается, что в 2014 году в США произойдет 74 690 новых случаев рака мочевого пузыря. По оценкам, в этот период также произойдет 15 580 смертей, связанных с раком мочевого пузыря. 2 Точное раннее обнаружение опухолей и точный мониторинг реакции опухоли на лечение являются ключом к выживанию пациентов. 77 До 70% пациентов с немышечно-инвазивным раком мочевого пузыря разовьются местный рецидив после трансуретральной резекции опухоли. 78,79
Гистологические и биологические характеристики рака мочевого пузыря у собак аналогичны таковым у людей. 80–82 По сравнению с людьми, переходно-клеточные карциномы у собак могут быть низкоуровневыми с поверхностным папиллярным появлением или представлять собой инвазивные опухоли высокой степени, которые распространяются через стенку мочевого пузыря в лимфатические узлы и другие органы, преимущественно печень и легкие . 80,83,84 Точная причина переходно-клеточного рака у собак до сих пор не известна; однако генетическая предрасположенность, пестициды, инсектициды и пассивное курение считаются основными факторами риска. 80,83,84 Рак мочевого пузыря у кошек встречается очень редко. 60
Одним из примеров использования собак с диагнозом переходно-клеточная карцинома в качестве модели рака является оценка новых средств визуализации для выявления рака мочевого пузыря. Описано специфическое поглощение фторококсиба А линиями первичной переходно-клеточной карциномы собак in vitro 19 , а также встречающейся в природе переходно-клеточной карциномой во время обследования собак. 19,85
Остеосаркома
OSA — наиболее распространенный вид рака костей у детей и подростков. Ежегодно в США регистрируется около 800 новых случаев ОАС, из них около 400 — у детей и подростков. 2 OSA — наиболее распространенная первичная опухоль костей у собак. 86 На его долю приходится до 85–98% всех опухолей костей собак, 87 и> 80% зарегистрированных случаев приходится на гигантские и крупные породы, включая ротвейлера, шотландского дирхаунда, немецкую овчарку, добермана, великого Датчанин и Грейхаунд. 88 Обычные методы лечения ОАС включают ампутацию конечности и химиотерапию с выживаемостью в течение 1 года менее 50% и 20% или менее выживаемостью 2 года и более. Основная проблема — метастазы, возникающие до ампутации конечности. Собаки с СОАС представляют собой уникальную модель заболевания у людей из-за сходной гистопатологии, клинических проявлений и молекулярных мишеней, а также схожих мест метастазов и показателей выживаемости. 87 Собаки были ценной моделью OSA и использовались в клинических испытаниях новаторских методов спасения конечностей, которые сейчас используются у людей. 89 ОАС у кошек встречается редко; тем не менее, OSA скелета кошек и собак имеют схожие гистологические особенности, хотя и имеют разные прогностические характеристики. 90
Рак груди
Рак груди является вторым по частоте диагностированием рака у женщин. Ожидается, что в течение 2014 года в США будет диагностировано более 230 000 новых случаев инвазивного рака груди. 2 Новообразования молочной железы являются наиболее распространенной опухолью у неоплаченных самок собак, составляя 52% всех новообразований. 12 Опухоли молочной железы у собак сходны с опухолями молочной железы у людей во многих аспектах, включая гормональную зависимость, характер метастазов, возраст и роль факторов окружающей среды в возникновении заболевания. 12 До 60% случаев рака у человека и 45% рака груди у собак являются рецепторами эстрогена, 64 и ранняя стерилизация предотвращает развитие рака груди у собак. 91,92 Наиболее распространенным вариантом лечения рака груди у собак является хирургическое вмешательство, а химиотерапия используется редко. 12 Опухоли молочных желез являются третьими по распространенности новообразованиями у кошек после лимфоидных и кожных злокачественных новообразований, причем 80–90% составляют злокачественные опухоли, большинство из которых являются аденокарциномами. 12 Только 10% опухолей молочной железы у кошек являются рецепторами эстрогена, поэтому стерилизация очень мало влияет на рецидив рака или выживаемость кошек. 93
Рак простаты
Рак простаты — это наиболее часто диагностируемый вид рака у мужчин, помимо рака кожи. По оценкам, в США в 2014 году было диагностировано более 230 000 новых случаев. 2 Собаки — единственные крупные млекопитающие, кроме человека, со значительной частотой спонтанного рака простаты. 94 Частая встречаемость метастазов в кости и андроген-независимых заболеваний у собак с раком простаты представляет собой модель для изучения методов лечения распространенного, гормонально-невосприимчивого рака простаты у людей. 94 Варианты лечения рака простаты включают местную и системную терапию, а также нестероидные противовоспалительные препараты для улучшения качества жизни. 95 Очень мало случаев рака простаты было зарегистрировано у домашних кошек, большинство из которых представляют собой карциномы высокой степени злокачественности с метастазами в лимфатические узлы и легкие. 93
Рак легкого
Рак легких является причиной большинства смертей от рака у мужчин (28%) и женщин (26%), при этом в США в 2014 году по оценкам было зарегистрировано более 220 000 новых случаев. 2 У собак и кошек рак легких развивается редко; общая заболеваемость составляет 1%, большинство из которых составляют аденокарциномы. 12,96 Хирургическое удаление остается основным методом лечения рака легких у собак.Исследования показали значительное увеличение числа злокачественных опухолей дыхательных путей у собак, подвергшихся воздействию сигаретного дыма, 97 , поэтому собак можно использовать для изучения влияния факторов окружающей среды на канцерогенез в качестве эпидемиологической модели, а также диагностических и терапевтических модель рака легких.
Меланома
Другой тип рака, который представляет собой ценную модель рака человека, — это меланома собаки. По оценкам, в США в 2014 г. будет 43 890 и 32 210 новых случаев меланомы кожи у мужчин и женщин соответственно. 2 Химиотерапия принесла мало пользы пациентам с меланомой, но разработка целевых (протоонкоген B-Raf, внеклеточная сигнально-регулируемая киназа [ERK] или ингибиторы c-Kit) и новых иммунных подходов радикально изменила прогноз. 98 В отличие от генно-инженерных моделей, спорадические меланоцитарные новообразования собак имеют несколько общих характеристик с меланомой человека, 99 , что делает собак более подходящей доклинической моделью для разработки клинических испытаний. 100 Меланомы собак редко возникают на участках, подверженных воздействию солнечных лучей, и чаще всего возникают в полости рта, имитируя меланому слизистой оболочки человека.Спектр меланоцитарной неоплазии собак включает доброкачественные образования, в некоторой степени аналогичные невусам, а также инвазивную первичную меланому и широко распространенные метастазы. 99 Меланома часто встречается у собак 60,101,102 , но редко у кошек. 60,103
Другие виды рака
По оценкам, в 2014 г. в США будет зарегистрировано примерно 12 000 и 23 380 новых случаев рака мягких тканей и мозга человека, соответственно. 2 Саркомы мягких тканей представляют собой гетерогенную популяцию мезенхимальных опухолей, которые составляют 15% и 7% всех кожных и подкожных опухолей у собак и кошек, соответственно.Гемангиосаркомы, хондросаркомы, липомы, опухоли головного мозга и саркомы мягких тканей у собак являются ценными моделями рака мягких тканей человека. 60
Молекулярные маркеры для обнаружения и лечения рака
Для улучшения выявления и лечения рака на более ранних стадиях требуется разработка методов молекулярной визуализации опухолей и терапевтических препаратов. 1 В отличие от традиционной химиотерапии, которая влияет на все быстро делящиеся клетки, таргетная терапия использует индивидуальный подход к подавлению опухолевых клеток, основанный на ингибировании идентифицированных сигнальных путей, управляющих опухолью.Повышенная сложность взаимодействия между сигнальными путями и наборами данных из различных типов рака привела к разработке новых вычислительных моделей для прогнозирования активности целевых сигнальных путей, ответов на терапию и прогноза у больных раком. 104
Существует несколько основных онкогенных сигнальных путей, которые играют роль в росте и прогрессировании опухоли: рецепторная тирозинкиназа, то есть рецепторы фактора роста, такие как рецептор фактора роста эндотелия сосудов (VEGFR), рецептор эпидермального фактора роста (EGFR), тромбоцитарный. рецептор фактора роста, рецептор фактора роста фибробластов, c-Met и рецептор инсулиноподобного фактора роста 1; Src; Ras / Raf / митоген-активированная протеинкиназа / ERK; фосфатидилинозитид-3-киназа; Рецептор, связанный с G-белком; pRb; Еж; Wnt-β-катенин; трансформирующий фактор роста-β; ядерный фактор, энхансер легкой каппа-цепи активированных В-клеток (NFκB), включая его мишень СОХ-2; и пути передачи сигналов Notch. 105 Поскольку эти молекулы экспрессируются на высоком уровне при раке, но не в окружающих нормальных тканях, они являются привлекательными мишенями для селективного обнаружения и лечения рака. Большинство таргетных методов лечения представляют собой низкомолекулярные препараты или моноклональные антитела. Кандидаты на получение низкомолекулярных препаратов обычно выявляются при проверке лекарств, оценивающей влияние тысяч тестируемых соединений на конкретную мишень.
Первой молекулярной мишенью для таргетной терапии рака был рецептор эстрогена при раке груди.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило несколько препаратов для лечения рака груди, положительного по рецепторам эстрогена, включая тамоксифен, фулвестрант, торемифен и ингибиторы ароматазы. 106 Семейство рецепторов тирозинкиназы (TK) играет важную роль в регуляции рака. EGFR, 107 c-Kit, рецептор фактора роста тромбоцитов-α / β, киназы семейства Src, 7,108 PI3K / протеинкиназа B (AKT) / пути рапамицина (mTOR) млекопитающих, 109 и VEGFR , 110, обычно сверхэкспрессируются и являются эффективными молекулярными мишенями для лечения рака.Они называются ингибиторами сигнальной трансдукции и включают мезилат иматиниба (TK), дазатиниб (TK), нилотиниб (TK), трастузумаб (рецептор 2 эпидермального фактора роста человека [HER-2]), пертузумаб (HER-2), гефитиниб (EGFR ), эрлотиниб (EGFR, другие TK), цетуксимаб (EGFR), вандетаниб (VEGFR) и сорафениб (VEGF). 111 Другие таргетные методы лечения изменяют функцию белков, которые регулируют экспрессию генов и другие клеточные функции, такие как вориностат (ингибитор гистондеацетилазы). Дальнейшие целевые методы лечения индуцируют апоптоз опухолевых клеток, такие как бортезомиб (протеасома) 112,113 , и другие группы нацелены на иммунную систему, чтобы помочь разрушить раковые клетки, такие как ритуксимаб (CD20). 114,115 Другой класс таргетной терапии включает моноклональные антитела, которые доставляют токсичные молекулы конкретно к раковым клеткам, такие как ибритумомаб (нацелены на CD20 + неходжкинскую B-клеточную лимфому [B-клетки NHL] путем доставки радиоактивного 111-индия или 90 -иттрий). 116
Воспаление является признаком рака и, как было показано, играет ключевую роль в возникновении и прогрессировании болезни. 1 Было также показано, что многие типы рака, которые сверхэкспрессируют EGFR, сверхэкспрессируют COX-2, 117 , который находится ниже сигнального пути NFκB.ЦОГ-2 увеличивается в воспалительных и предраковых поражениях 118–120 и экспрессируется на еще более высоких уровнях в карциномах. 81,121,122 Генетические исследования на трансгенных мышах со сверхэкспрессией ЦОГ-2 подтвердили повышенное развитие метастатических опухолей, мыши 123,124 и ЦОГ-2 — / — показали снижение развития опухолей кишечника и кожи. 125,126 Аналогичным образом, когда активность СОХ-2 подавлялась фармакологически нестероидными противовоспалительными препаратами (НПВП), развитие карциномы молочной железы у склонных к опухолям трансгенных мышей сильно подавлялось. 127 НПВП являются одними из самых широко используемых в мире рецептурных и безрецептурных препаратов. 128,129 Идентификация второй изоформы фермента ЦОГ, ЦОГ-2, привела к открытию нового класса селективных ингибиторов ЦОГ-2, т.е. ЦОКСИБ, включая рофекоксиб, целекоксиб, валдекоксиб, эторикоксиб и люмиракоксиб. 128,130 Использование радиоактивно или флуоресцентно меченных COXIB в качестве нового класса визуализирующих агентов основано на избирательном захвате неопластическими поражениями, экспрессирующими COX-2. 26,117,131,132
По данным Национального института рака, вакцины против рака и генная терапия часто считаются целевыми методами лечения, поскольку они препятствуют росту определенных раковых клеток. 111
Таргетная терапия позволила добиться значительного прогресса в лечении рака и показала многообещающие результаты в сочетании с другими методами лечения. 133–145 Таргетная терапия хорошо переносится, хотя по-прежнему часто наблюдаются различные побочные эффекты, включая сыпь, диарею, гипертонию, гипотиреоз, протеинурию, гепатотоксичность, депигментацию, глазную токсичность, гипергликемию и дислипидемию. 146
Заключение
В этом обзоре описано несколько доклинических моделей рака, которые можно использовать для диагностики, лечения или прогноза. Основное внимание уделяется их сильным и слабым сторонам, полезности и значимости при разработке новых терапевтических препаратов и средств визуализации для клинического применения. Решение о том, какую модель рака использовать, зависит от стадии открытия лекарства (см. Рисунок 1). Однако окончательное доказательство концепции эффективности и безопасности новых терапевтических препаратов и препаратов для визуализации находится на людях.Подход персонализированной медицины все еще находится на начальной стадии, но показывает первые преимущества протоколов селективной таргетной терапии для отдельных онкологических пациентов. По-прежнему необходимы дальнейшие исследования в отношении идентификации новых молекулярных мишеней, разработки новых лекарств, идентификации подходящих пациентов, которым может помочь терапия, сроков введения лекарств для комбинированной терапии, уменьшения побочных эффектов лечения и лучшего понимания лекарственной устойчивости.
Благодарность
Мы благодарим доктора Лежандра за критическое рассмотрение этой статьи.
Вклад авторов
MC разработал, получил и интерпретировал данные, написал и утвердил окончательный вариант рукописи, разработал рисунки и согласился нести ответственность за все аспекты работы. KR получил и интерпретировал данные, написал и утвердил окончательную рукопись, подготовил рисунки, а также согласился нести ответственность за все аспекты работы.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Список литературы
1. | Ханахан Д., Вайнберг, РА. Признаки рака: следующее поколение. Ячейка . 2011. 144 (5): 646–674. |
2. | Американское онкологическое общество. Факты и цифры по раку, 2014 г. Доступно по адресу: http://www.cancer.org/acs/groups/content/@research/documents/webcontent/acspc-042151.pdf. По состоянию на 2 апреля 2014 г. |
3. | Masters JR. Клетки HeLa спустя 50 лет: хорошие, плохие и уродливые. Нат Рев Рак . 2002. 2 (4): 315–319. |
4. | Harris SA, Enger RJ, Riggs BL, Spelsberg TC. Разработка и характеристика условно иммортализованной линии остеобластных клеток плода человека. Дж Боун Минер Рес . 1995. 10 (2): 178–186. |
5. | Фичорова Р.Н., Райнвальд Дж. Г., Андерсон Д. Создание иммортализованных линий клеток папилломавируса из нормального эктоцервикального, эндоцервикального и вагинального эпителия человека, которые поддерживают экспрессию тканеспецифических белков дифференцировки. Биол Репрод . 1997. 57 (4): 847–855. |
6. | Welte Y, Davies C, Schafer R, Regenbrecht CR. Культура клеток, полученная пациентом, и выделение предполагаемых раковых стволовых клеток CD133 (+) из меланомы. J Vis Exp . 2013; 73: e50200. |
7. | Ратор К., Александр М., Цеканова М. Пироксикам ингибирует индуцированную маситинибом экспрессию циклооксигеназы 2 в клетках плоскоклеточного рака полости рта in vitro. Перевод Рез. . 21 февраля 2014 г. [Epub перед печатью.] |
8. | Cekanova M, Masi T, Plummer HK 3rd, Majidi M, Fedorocko P, Schuller HM. Легочные фибробласты стимулируют пролиферацию клеточных линий аденокарцином легких человека. Противоопухолевые препараты . 2006. 17 (7): 771–781. |
9. | Ван Ц., Тан З., Чжао Ю., Яо Р., Ли Л., Сун В. Трехмерные модели рака in vitro: краткий обзор. Биологическое производство . 2014; 6 (2): 022001. |
10. | Knapp DW, Waters DJ. Естественный рак у домашних собак: важные модели для разработки улучшенной терапии рака для людей. Мол Мед Сегодня . 1997. 3 (1): 8–11. |
11. | Spugnini EP, Porrello A, Citro G, Baldi A. Сверхэкспрессия COX-2 в опухолях собак: потенциальные терапевтические мишени в онкологии. Гистол Гистопатол .2005. 20 (4): 1309–1312. |
12. | MacEwen EG. Спонтанные опухоли у собак и кошек: модели для изучения биологии рака и лечения. Метастазы рака Ред. . 1990. 9 (2): 125–136. |
13. | Cheon DJ, Orsulic S. Мышиные модели рака. Анну Рев Патол . 2011; 6: 95–119. |
14. | Ruggeri BA, Camp F, Miknyoczki S.Модели болезней на животных: доклинические модели рака на животных, их применение и полезность в открытии лекарств. Биохим Фармакол . 2014. 87 (1): 150–161. |
15. | Huynh AS, Abrahams DF, Torres MS, Baldwin MK, Gillies RJ, Morse DL. Разработка модели ксенотрансплантата ортотопического рака поджелудочной железы человека с использованием инъекции клеток под ультразвуковым контролем. PLoS Один . 2011; 6 (5): e20330. |
16. | Бибби М.С. Ортотопические модели рака для доклинической оценки лекарственных средств: преимущества и недостатки. евро J Рак . 2004. 40 (6): 852–857. |
17. | Morton CL, Houghton PJ. Создание ксенотрансплантатов опухоли человека у иммунодефицитных мышей. Nat Protoc . 2007. 2 (2): 247–250. |
18. | Шарплесс, NE, Депино, РА. Могучая мышь: генно-инженерные модели мышей в разработке лекарств от рака. Нат Рев Лекарство Дисков . 2006. 5 (9): 741–754. |
19. | Cekanova M, Uddin MJ, Bartges JW, et al. Молекулярная визуализация циклооксигеназы-2 в переходно-клеточных карциномах собак in vitro и in vivo. Cancer Prev Res (Phila) . 2013. 6 (5): 466–476. |
20. | Frese KK, Tuveson DA. Максимизация моделей рака у мышей. Нат Рев Рак . 2007. 7 (9): 645–658. |
21. | Zupancic D, Kreft ME, Romih R. Селективное связывание лектинов с нормальным и неопластическим уротелием в моделях канцерогенеза мочевого пузыря крыс и мышей. Протоплазма . 2014. 251 (1): 49–59. |
22. | Огава К., Джон М.С., Де Оливейра М.Л. и др. Сравнение экспрессии уроплакина во время уротелиального канцерогенеза, индуцированного N-бутил-N- (4-гидроксибутил) нитрозамином у крыс и мышей. Токсикол Патол . 1999. 27 (6): 645–651. |
23. | Becci PJ, Thompson HJ, Strum JM, Brown CC, Sporn MB, Moon RC. N-бутил-N- (4-гидроксибутил) нитрозамин-индуцированный рак мочевого пузыря у мышей C57BL / 6 X DBA / 2 F1 как полезная модель для изучения химиопрофилактики рака с помощью ретиноидов. Cancer Res . 1981; 41 (3): 927–932. |
24. | McCormick DL, Ronan SS, Becci PJ, Moon RC. Влияние общей дозы и режима доз на индукцию рака мочевого пузыря у мышей N-бутил-N- (4-гидроксибутил) нитрозамином. Канцерогенез . 1981; 2 (3): 251–254. |
25. | Schuller HM, Cekanova M. NNK-индуцированные аденокарциномы легких хомяка сверхэкспрессируют бета2-адренергические пути и пути передачи сигналов EGFR. Рак легких . 2005. 49 (1): 35–45. |
26. | Schuller HM, Kabalka G, Smith G, Mereddy A, Akula M, Cekanova M. Обнаружение сверхэкспрессии COX-2 в предраковых поражениях поджелудочной железы и легких хомячка с помощью молекулярной визуализации: последствия для ранняя диагностика и профилактика. ХимМедХим . 2006; 1 (6): 603–610. |
27. | Russell WL, Kelly EM, Hunsicker PR, Bangham JW, Maddux SC, Phipps EL. Тест на специфический локус показывает, что этилнитрозомочевина является наиболее сильным мутагеном у мышей. Proc Natl Acad Sci U S A . 1979; 76 (11): 5818–5819. |
28. | Neufert C, Becker C, Neurath MF. Модель индуцируемых мышей канцерогенеза толстой кишки для анализа спорадического и вызванного воспалением прогрессирования опухоли. Nat Protoc . 2007; 2 (8): 1998–2004. |
29. | Tanaka T, Kohno H, Suzuki R, Yamada Y, Sugie S., Mori H. Новая модель канцерогенеза толстой кишки у мышей, вызванного воспалением, индуцированная азоксиметаном и сульфатом натрия декстрана. Раковые науки . 2003. 94 (11): 965–973. |
30. | Денисенко М.Ф., Пао А, Тан М, Пфейфер Г.П. Предпочтительное образование аддуктов бензо [a] пирена в горячих точках мутаций рака легких в P53. Наука . 1996. 274 (5286): 430–432. |
31. | Cekanova M, Lee SH, Donnell RL, et al. Экспрессия гена-1, активируемого нестероидными противовоспалительными препаратами, ингибирует индуцированный уретаном онкогенез легких у трансгенных мышей. Cancer Prev Res (Phila) . 2009. 2 (5): 450–458. |
32. | Barrett JC, Lamb PW, Wiseman RW. Множественные механизмы канцерогенного действия асбеста и других минеральных волокон. Специалист по охране здоровья окружающей среды . 1989. 81: 81–89. |
33. | Сингх М., Джонсон Л. Использование генно-инженерных мышиных моделей рака для помощи в разработке лекарств: отраслевые перспективы. Clin Cancer Res . 2006. 12 (18): 5312–5328. |
34. | Зауэр Б. Функциональная экспрессия системы сайт-специфической рекомбинации cre-lox в дрожжах Saccharomyces cerevisiae. Мол Ячейки Биол .1987. 7 (6): 2087–2096. |
35. | Госсен М., Бужард Х. Жесткий контроль экспрессии генов в клетках млекопитающих с помощью промоторов, чувствительных к тетрациклину. Proc Natl Acad Sci U S A . 1992. 89 (12): 5547–5551. |
36. | Schlake T., Bode J. Использование мутированных сайтов-мишеней распознавания FLP (FRT) для обмена кассет экспрессии в определенных хромосомных локусах. Биохимия .1994. 33 (43): 12746–12751. |
37. | Адамс Дж. М., Кори С. Трансгенные модели развития опухолей. Наука . 1991. 254 (5035): 1161–1167. |
38. | Дикинс Р.А., МакДжанкин К., Эрнандо Э. и др. Тканеспецифическая и обратимая интерференция РНК у трансгенных мышей. Нат Генет . 2007. 39 (7): 914–921. |
39. | Стюарт Т.А., Паттенгейл П.К., Ледер П.Спонтанные аденокарциномы молочной железы у трансгенных мышей, которые несут и экспрессируют гены слияния MTV / myc. Ячейка . 1984. 38 (3): 627–637. |
40. | Jacks T, Fazeli A, Schmitt EM, Bronson RT, Goodell MA, Weinberg RA. Эффекты мутации Rb у мышей. Природа . 1992. 359 (6393): 295–300. |
41. | Фодде Р., Эдельманн В., Ян К. и др. Нацеленная мутация обрыва цепи в гене мышиного Apc приводит к множественным опухолям кишечника. Proc Natl Acad Sci U S A . 1994. 91 (19): 8969–8973. |
42. | Ямагути К., Чеканова М., МакЭнти М.Ф. и др. Лиганд рецептора, активируемого пролифератором пероксисом, MCC-555 подавляет полипы кишечника у мышей ApcMin / + посредством регулируемых внеклеточным сигналом киназы и рецептор-зависимых путей, активируемых пролифератором пероксисом. Мол Рак Тер . 2008. 7 (9): 2779–2787. |
43. | Hung KE, Maricevich MA, Richard LG и др.Разработка мышиной модели спорадических и метастатических опухолей толстой кишки и ее использование при оценке лекарственного лечения. Proc Natl Acad Sci U S A . 2010. 107 (4): 1565–1570. |
44. | Coffee EM, Faber AC, Roper J, et al. Сопутствующая блокада BRAF и PI3K / mTOR необходима для эффективного лечения колоректального рака BRAF (V600E). Clin Cancer Res . 2013; 19 (10): 2688–2698. |
45. | Martin ES, Belmont PJ, Sinnamon MJ, et al.Разработка модели ортотопической трансплантации рака толстой кишки на основе GEMM для открытия и проверки лекарств. Clin Cancer Res . 2013. 19 (11): 2929–2940. |
46. | Роуэлл Дж. Л., Маккарти Д. О., Альварес К. Э. Собачьи модели естественного рака. Тенденции Мол Меди . 2011. 17 (7): 380–388. |
47. | Мак И.В., Эванев Н., Герт М. Трудности перевода: модели на животных и клинические испытания в лечении рака. Am J Transl Res . 2014. 6 (2): 114–118. |
48. | Тейчер Б.А. Анализы in vivo / ex vivo и in situ, используемые в исследованиях рака: краткий обзор. Токсикол Патол . 2009. 37 (1): 114–122. |
49. | Mazcko C. Программа сравнительной онкологии, 2012 г. Доступно по адресу: https://ccrod.cancer.gov/confluence/display/CCRCOPWeb/Home. По состоянию на 28 марта 2014 г. |
50. | Паолони М., Кханна К. Перевод новых методов лечения рака от домашних собак к людям. Нат Рев Рак . 2008. 8 (2): 147–156. |
51. | Khanna C, Lindblad-Toh K, Vail D, et al. Собака как модель рака. Нат Биотехнология . 2006. 24 (9): 1065–1066. |
52. | Lindblad-Toh K, Wade CM, Mikkelsen TS, et al. Последовательность генома, сравнительный анализ и структура гаплотипов домашней собаки. Природа . 2005. 438 (7069): 803–819. |
53. | Мендоза С., Кониши Т., Дернелл В.С., Витроу С.Дж., Миллер К.В. Состояние генов p53, Rb и MDM2 при остеосаркоме собак. Противораковое лечение . 1998. 18 (6a): 4449–4453. |
54. | Ривера П., Мелин М., Биаги Т. и др. Развитие опухоли молочной железы у собак связано с BRCA1 и BRCA2. Cancer Res . 2009. 69 (22): 8770–8774. |
55. | Брин М., Модиано Дж. Ф. Эволюционно консервативные цитогенетические изменения в гематологических злокачественных новообразованиях собак и людей — человека и его лучшего друга объединяет больше, чем просто общение. Резюме хромосомы . 2008. 16 (1): 145–154. |
56. | Gregory-Bryson E, Bartlett E, Kiupel M, Hayes S, Yuzbasiyan-Gurkan V. Стромальные опухоли желудочно-кишечного тракта собак и человека демонстрируют аналогичные мутации в экзоне 11 c-KIT. BMC Рак . 2010; 10: 559. |
57. | Porrello A, Cardelli P, Spugnini EP. Онкология домашних животных как модель для человека. обзор гистотипов опухолей. J Exp Clin Cancer Res . 2006. 25 (1): 97–105. |
58. | Общество лейкемии и лимфомы. Факты, 2014 г. Доступно по адресу: http://www.lls.org/content/nationalcontent/resourcecenter/freeeducationmaterials/generalcancer/pdf/facts.pdf. По состоянию на 29 апреля 2014 г. |
59. | Marconato L, Gelain ME, Comazzi S. Собака как возможная животная модель неходжкинской лимфомы человека: обзор. Гематол Онкол . 2013; 31 (1): 1–9. |
60. | Витроу С.Дж., Вейл Д.М., Пейдж РЛ, редакторы. Клиническая онкология мелких животных Витроу и Макьюэна . 5-е изд. Сент-Луис, Миссури, США: Эльзевир; 2012. |
61. | Зам Ш., Блер А. Пестициды и неходжкинская лимфома. Cancer Res . 1992; 52 (Дополнение 19): 5485s – 5488s. |
62. | Хан К.А., Браво Л., Адамс У.Х., Фрейзер Д.Л. Встречающиеся в природе опухоли у собак как сравнительные модели для исследований терапии рака. В естественных условиях . 1994. 8 (1): 133–143. |
63. | Vail DM, MacEwen EG. Спонтанно возникающие опухоли у домашних животных как модели рака человека. Рак Инвест . 2000. 18 (8): 781–792. |
64. | Хансен К., Ханна К. Спонтанные и генно-инженерные модели животных; использование в доклинической разработке лекарств от рака. евро J Рак . 2004. 40 (6): 858–880. |
65. | MacEwen EG, Rosenthal RC, Fox LE, Loar AS, Kurzman ID. Оценка конъюгата L-аспарагиназа: полиэтиленгликоль по сравнению с нативной L-аспарагиназой в сочетании с химиотерапией.Рандомизированное двойное слепое исследование лимфомы собак. J Ветеринарный врач-интерн . 1992. 6 (4): 230–234. |
66. | Раджу Б., Ибрагим СО. Патофизиология рака полости рта на экспериментальных моделях животных: обзор с акцентом на роль симпатических нервов. Дж. Орал Патол Мед . 2011; 40 (1): 1–9. |
67. | Boria PA, Murry DJ, Bennett PF и др. Оценка цисплатина в сочетании с пироксикамом для лечения злокачественной меланомы полости рта и плоскоклеточного рака полости рта у собак. J Am Vet Med Assoc . 2004. 224 (3): 388–394. |
68. | Reif JS, Bruns C, Lower KS. Рак носовой полости и придаточных пазух носа и воздействие табачного дыма из окружающей среды у домашних собак. Am J Epidemiol . 1998. 147 (5): 488–492. |
69. | Николлс П.К., Клаунберг Б.А., Мур Р.А. и др. Встречающаяся в природе, не регрессирующая инфекция орального папилломавируса собак: иммунитет хозяина, характеристика вируса и экспериментальная инфекция. Вирусология . 1999. 265 (2): 365–374. |
70. | O’Neill SH, Newkirk KM, Anis EA, Brahmbhatt R, Frank LA, Kania SA. Обнаружение ДНК вируса папилломы человека в предраковой и инвазивной плоскоклеточной карциноме кошек. Ветеринарный дерматол . 2011; 22 (1): 68–74. |
71. | Мартин С.К., Дирксен В.П., Шу С.Т. и др. Характеристика резорбции кости в новых моделях плоскоклеточного рака полости рта in vitro и in vivo. Оральный онкол . 2012. 48 (6): 491–499. |
72. | ДиБернарди Л., Дор М., Дэвис Дж. А. и др. Изучение плоскоклеточного рака полости рта у кошек: потенциальная цель для лечения ингибиторами циклооксигеназы. Простагландины Leuk Essent жирные кислоты . 2007. 76 (4): 245–250. |
73. | Стеббинс К.Э., Морзе К.С., Голдшмидт М.Х. Неоплазия полости рта у кошек: десятилетний обзор. Ветеринарный врач .1989. 26 (2): 121–128. |
74. | Пуарье VJ, Kaser-Hotz B, Vail DM, Straw RC. Эффективность и токсичность протокола ускоренной гипофракционированной лучевой терапии у кошек с плоскоклеточной карциномой полости рта. Ветеринарная радиология УЗИ . 2013. 54 (1): 81–88. |
75. | Marretta JJ, Garrett LD, Marretta SM. Плоскоклеточный рак ротовой полости кошек: обзор. Доступно по адресу: http: // veterinarymedicine.dvm360.com/vetmed/Medicine/Feline-oral-squamous-cell-carcinoma-An-overview/ArticleStandard/Article/detail/433715. По состоянию на 8 июля 2014 г. |
76. | Wypij JM. Встречающаяся в природе модель плоскоклеточного рака головы и шеи у кошек. Патолог Res Int . 2013; 2013: 502197. |
77. | Шапиро А., Гофрит О.Н., Пизов Г., Коэн Дж.К., Майер Дж. Рамановская молекулярная визуализация: новый спектроскопический метод диагностики рака мочевого пузыря в образцах мочи. Евро Урол . 2011. 59 (1): 106–112. |
78. | Kurth KH. Диагностика и лечение поверхностного переходно-клеточного рака мочевого пузыря: факты и перспективы. Евро Урол . 1997; 31 Дополнение 1: 10–19. |
79. | Аллард П., Бернар П., Фрадет Й., Тету Б. Раннее клиническое течение первичного рака мочевого пузыря Та и Т1: предлагаемый прогностический индекс. Br J Урол .1998. 81 (5): 692–698. |
80. | Mohammed SI, Knapp DW, Bostwick DG, et al. Экспрессия циклооксигеназы-2 (COX-2) при инвазивной переходно-клеточной карциноме мочевого пузыря человека (TCC). Cancer Res . 1999. 59 (22): 5647–5650. |
81. | Pestili de Almeida EM, Piche C, Sirois J, Dore M. Экспрессия циклооксигеназы-2 в встречающихся в природе плоскоклеточных карциномах у собак. Дж. Гистохим Цитохим . 2001. 49 (7): 867–875. |
82. | Mutsaers AJ, Widmer WR, Knapp DW. Переходно-клеточная карцинома собак. J Ветеринарный врач-интерн . 2003. 17 (2): 136–144. |
83. | Кнапп Д.В., Ричардсон Р.С., Чан Т.С. и др. Терапия пироксикамом у 34 собак с переходноклеточной карциномой мочевого пузыря. J Ветеринарный врач-интерн . 1994. 8 (4): 273–278. |
84. | Муцаерс А.Дж., Видмер В.Р., Кнапп Д.В. Переходно-клеточная карцинома собак. J Ветеринарный врач-интерн . 2003. 17 (2): 136–144. |
85. | Cekanova M, Uddin MJ, Legendre AM, et al. Безопасность однократной дозы и фармакокинетическая оценка фторококсиба А: пилотное исследование нового агента для оптической визуализации, нацеленного на циклооксигеназу-2, на модели собаки. Дж. Биомед Опт . 2012; 17 (11): 116002. |
86. | Brodey RS, стояк WH. Остеосаркома собак — клинико-патологическое исследование 194 случаев. Клин Ортоп Релат Рес . 1969; 62: 54–64. |
87. | Морелло Э., Мартано М., Буракко П. Биология, диагностика и лечение остеосаркомы аппендикуляра собак: сходства и различия с остеосаркомой человека. Ветеринар J . 2011. 189 (3): 268–277. |
88. | Ru G, Terracini B, Glickman LT.Факторы риска остеосаркомы собак, связанные с хозяином. Ветеринар J . 1998. 156 (1): 31–39. |
89. | ЛаРю С.М., Витроу С.Дж., Пауэрс Б.Е. и др. Остеосаркома у собак с сохранением конечностей. J Am Vet Med Assoc . 1989; 195 (12): 1734–1744. |
90. | Dimopoulou M, Kirpensteijn J, Moens H, Kik M. Гистологические прогностические факторы при остеосаркоме кошек: сравнение с фенотипически сходной остеосаркомой собак. Ветеринарная служба . 2008. 37 (5): 466–471. |
91. | Sonnenschein EG, Glickman LT, Goldschmidt MH, McKee LJ. Строение тела, диета и риск рака груди у домашних собак: исследование случай-контроль. Am J Epidemiol . 1991. 133 (7): 694–703. |
92. | Фонд здоровья собак Американского клуба собаководства. Определение наилучшего возраста для стерилизации или стерилизации. Доступно по адресу: http: // www.akcchf.org/canine-health/your-dogs-health/determining-the-best-age-at.html. По состоянию на 6 февраля 2014 г. |
93. | Morrison WB. Рак у собак и кошек . 1-е изд. Балтимор, Мэриленд, США: Williams & Wilkins; 1998. |
94. | Лерой Б. Е., Нортруп Н. Рак простаты у собак: сравнительные и клинические аспекты. Ветеринар J . 2009. 180 (2): 149–162. |
95. | Axiak SM, Bigio A. Карцинома предстательной железы у собак. Справочник Contin Educ Vet . 2012; 34 (10): E1 – E5. |
96. | Hifumi T., Miyoshi N, Kawaguchi H, Nomura K, Yasuda N. Иммуногистохимическое определение белков, связанных с множественной лекарственной устойчивостью к противораковым препаратам при первичной карциноме легких у собак и кошек. Журнал ветеринарной медицины . 2010. 72 (5): 665–668. |
97. | Коггинс CR. Мини-обзор исследований хронического вдыхания животных сигаретным дымом. Токсикол для вдыхания . 2002. 14 (10): 991–1002. |
98. | Штивельман Э., Дэвис М.А., Хву П. и др. Пути и терапевтические цели при меланоме. Мишень . 2014. 5 (7): 1701–1752. |
99. | Simpson RM, Bastian BC, Michael HT, et al. Спорадическая естественная меланома у собак как доклиническая модель меланомы человека. Пигментная клетка Melanoma Res . 2014. 27 (1): 37–47. |
100. | Бергман П.Дж., Макнайт Дж., Новосад А. и др. Долгосрочное выживание собак с запущенной злокачественной меланомой после ДНК-вакцинации ксеногенной тирозиназой человека: испытание фазы I. Clin Cancer Res . 2003. 9 (4): 1284–1290. |
101. | Goldschmidt MH. Пигментные поражения кожи. Клин Дерматол .1994. 12 (4): 507–514. |
102. | Modiano JF, Ritt MG, Wojcieszyn J. Молекулярные основы меланомы собак: патогенез и тенденции в диагностике и терапии. J Ветеринарный врач-интерн . 1999. 13 (3): 163–174. |
103. | Smith SH, Goldschmidt MH, McManus PM. Сравнительный обзор меланоцитарных новообразований. Ветеринарный врач . 2002. 39 (6): 651–678. |
104. | Verhaegh W, van Ooijen H, Inda MA, et al. Выбор индивидуальной терапии для пациентов с использованием компьютерных моделей, основанных на знаниях, которые определяют пути передачи сигнала, управляющего опухолью. Cancer Res . 2014. 74 (11): 2936–2945. |
105. | Weinberg RA. Биология рака . 2-е изд. Нью-Йорк, Нью-Йорк, США; Garland Science, Тейлор и Фрэнсис Групп; 2014. |
106. | Джайтак В. Стратегии лекарственной мишени в лечении рака груди: последние разработки. Противоопухолевые агенты Med Chem . 7 апреля 2014 г. [Epub перед печатью.] |
107. | Xia W, Lau YK, Zhang HZ, et al. Комбинация EGFR, HER-2 / neu и HER-3 является более сильным предиктором исхода плоскоклеточной карциномы полости рта, чем любые отдельные члены семьи. Clin Cancer Res . 1999. 5 (12): 4164–4174. |
108. | Dubreuil P, Letard S, Ciufolini M, et al. Маситиниб (AB1010), мощный и селективный ингибитор тирозинкиназы, нацеленный на KIT. PLoS Один . 2009; 4 (9): e7258. |
109. | Ciruelos Gil EM. Нацеленность на путь PI3K / AKT / mTOR при раке молочной железы, положительном по рецепторам эстрогена. Лечение рака Ред. . 2014. 40 (7): 862–871. |
110. | Аль-Дисси А.Н., Хейнс Д.М., Сингх Б., Почек Б.А.Иммуногистохимическая экспрессия фактора роста эндотелия сосудов и рецептора фактора роста эндотелия сосудов, связанная с пролиферацией опухолевых клеток в плоскоклеточных карциномах кожи и трихоэпителиомах собак. Ветеринарный врач . 2007. 44 (6): 823–830. |
111. | Национальный институт рака. 2014. Доступно по адресу: http://www.cancer.gov. По состоянию на 30 апреля 2014 г. |
112. | Adams J, Kauffman M.Разработка ингибитора протеасом Велкейд (бортезомиб). Рак Инвест . 2004. 22 (2): 304–311. |
113. | Чен Д., Фрезза М., Шмитт С., Канвар Дж., Доу QP. Бортезомиб как первый противоопухолевый препарат, ингибирующий протеасомы: текущее состояние и перспективы на будущее. Текущее лекарство от рака нацелено на . 2011. 11 (3): 239–253. |
114. | Мэлони Д.Г., Грилло-Лопес А.Дж., Уайт Калифорния и др.Терапия моноклональными антителами к CD20 IDEC-C2B8 (ритуксимаб) у пациентов с рецидивом неходжкинской лимфомы низкой степени злокачественности. Кровь . 1997. 90 (6): 2188–2195. |
115. | Скотт С.Д. Ритуксимаб: новое терапевтическое моноклональное антитело для неходжкинской лимфомы. Рак Практик . 1998. 6 (3): 195–197. |
116. | Milenic DE, Brady ED, Brechbiel MW. Лучевая терапия рака, направленная на антитела. Нат Рев Лекарство Дисков . 2004. 3 (6): 488–499. |
117. | Данненберг А.Дж., Липпман С.М., Манн Дж.Р., Суббарамайя К., Дюбуа Р.Н. Циклооксигеназа-2 и рецептор эпидермального фактора роста: фармакологические мишени для химиопрофилактики. Дж. Клин Онкол . 2005. 23 (2): 254–266. |
118. | Taketo MM. ЦОГ-2 и рак толстой кишки. Inflamm Res . 1998; 47 Приложение 2: S112 – S116. |
119. | Eberhart CE, Coffey RJ, Radhika A, Giardiello FM, Ferrenbach S, DuBois RN. Повышение экспрессии гена циклооксигеназы 2 в колоректальных аденомах и аденокарциномах человека. Гастроэнтерология . 1994. 107 (4): 1183–1188. |
120. | Abdalla SI, Lao-Sirieix P, Novelli MR, Lovat LB, Sanderson IR, Fitzgerald RC. Гастрин-индуцированная экспрессия циклооксигеназы-2 в канцерогенезе Барретта. Clin Cancer Res .2004. 10 (14): 4784–4792. |
121. | Данненберг А.Дж., Суббарамайя К. Нацеленность на циклооксигеназу-2 при неоплазии человека: обоснование и перспективы. Раковые клетки . 2003. 4 (6): 431–436. |
122. | Фосслин Э. Молекулярная патология циклооксигеназы-2 при неоплазиях. Энн Клин Лаборатория Sci . 2000. 30 (1): 3–21. |
123. | Neufang G, Furstenberger G, Heidt M, Marks F, Muller-Decker K.Аномальная дифференцировка эпидермиса у трансгенных мышей, конститутивно экспрессирующих циклооксигеназу-2 в коже. Proc Natl Acad Sci U S A . 2001. 98 (13): 7629–7634. |
124. | Лю Ч., Чанг Ш., Нарко К. и др. Сверхэкспрессии циклооксигеназы-2 достаточно для индукции туморогенеза у трансгенных мышей. Дж. Биол. Хим. . 2001. 276 (21): 18563–18569. |
125. | Осима М., Динчук Ю.Е., Каргман С.Л. и др.Подавление полипоза кишечника у мышей с нокаутом Apc delta716 путем ингибирования циклооксигеназы 2 (ЦОГ-2). Ячейка . 1996. 87 (5): 803–809. |
126. | Chulada PC, Thompson MB, Mahler JF, et al. Генетическое нарушение Ptgs-1, а также Ptgs-2 снижает онкогенез кишечника у мышей Min. Cancer Res . 2000. 60 (17): 4705–4708. |
127. | Basu GD, Pathangey LB, Tinder TL, Lagioia M, Gendler SJ, Mukherjee P.Ингибитор циклооксигеназы-2 индуцирует апоптоз в клетках рака груди в модели спонтанного метастатического рака груди in vivo. Mol Cancer Res . 2004. 2 (11): 632–642. |
128. | Marnett LJ. Опыт COXIB: взгляд в зеркало заднего вида. Анну Рев Фармакол Токсикол . 2009. 49: 265–290. |
129. | Vane JR. Подавление синтеза простагландинов как механизм действия аспириноподобных препаратов. Нат Нью Биол . 1971. 231 (25): 232–235. |
130. | Talley JJ. Селективные ингибиторы циклооксигеназы-2 (ЦОГ-2). Прог Мед Хим . 1999; 36: 201–234. |
131. | Marnett LJ, Kalgutkar AS. Ингибиторы циклооксигеназы 2: открытие, селективность и будущее. Trends Pharmacol Sci . 1999. 20 (11): 465–469. |
132. | Kuge Y, Katada Y, Shimonaka S, et al.Синтез и оценка ингибиторов радиоактивного йода циклооксигеназы-2 как потенциальных индикаторов SPECT для экспрессии циклооксигеназы-2. Nucl Med Biol . 2006. 33 (1): 21–27. |
133. | Zhang J, Yu J, Sun X, Meng X. Ингибиторы тирозинкиназы рецептора эпидермального фактора роста при лечении метастазов в центральной нервной системе немелкоклеточного рака легкого. Раковые буквы . 2014; 351 (1): 6–12. |
134. | Бойд М., Мэйрс Р.Дж., Каннингем С.Х. и др. Стратегия генной терапии / направленной лучевой терапии для уничтожения радиационных клеток с помощью. Дж. Джин Мед. . 2001. 3 (2): 165–172. |
135. | Boyd M, Mairs RJ, Keith WN, et al. Эффективная стратегия направленной лучевой терапии / генной терапии с использованием промоторов теломеразы человека и радиоастатина и с использованием радиационно-опосредованных побочных эффектов. Дж. Джин Мед. . 2004. 6 (8): 937–947. |
136. | Boyd M, Mairs SC, Stevenson K, et al. Трансфектантные мозаичные сфероиды: новая модель для оценки уничтожения опухолевых клеток при направленной лучевой терапии и экспериментальной генной терапии. Дж. Джин Мед. . 2002. 4 (5): 567–576. |
137. | Cowen RL, Williams KJ, Chinje EC, et al. Направленная на гипоксия генная терапия для повышения эффективности тирапазамина в качестве адъюванта лучевой терапии: изменение радиорезистентности опухоли и эффективное лечение. Cancer Res . 2004. 64 (4): 1396–1402. |
138. | Каннингем С., Бойд М., Браун М.М. и др. Подход генной терапии для усиления направленной лучевой терапии нейробластомы. Медицинский педиатр Онкол . 2000. 35 (6): 708–711. |
139. | Fiveash JB, Gillespie GY, Oliver PG, Zhou T, Belenky ML, Buchsbaum DJ. Повышение эффективности лучевой терапии и химиотерапии глиомы с помощью таргетной терапии антителами против рецептора смерти 5. Int J Radiat Oncol Biol Phys . 2008. 71 (2): 507–516. |
140. | Fullerton NE, Boyd M, Mairs RJ, et al. Сочетание направленной лучевой терапии и генной терапии аденокарциномы простаты. Рак предстательной железы Простатический диск . 2004. 7 (4): 355–363. |
141. | Фуллертон, NE, Mairs RJ, Kirk D, et al. Применение направленной лучевой терапии / генной терапии к клеточным линиям рака мочевого пузыря. Евро Урол . 2005. 47 (2): 250–256. |
142. | Trachtenberg J, Weersink RA, Davidson SR, et al. Сосудистая фотодинамическая терапия (падопорфин, WST09) для рецидивирующего рака простаты после неэффективности дистанционной лучевой терапии: исследование возрастающих доз света. БЖУ Инт . 2008. 102 (5): 556–562. |
143. | Weiss GJ, Bunn PA Jr, Camidge DR. От лучевой терапии к таргетной терапии: 20 лет в лечении немелкоклеточного рака легкого. Онкология (Уиллистон-Парк) . 2006. 20 (12): 1515–1524. |
144. | Виллетт К.Г., Козин С.В., Дуда Д.Г. и др. Комбинированная терапия, направленная на фактор роста эндотелия сосудов, и лучевая терапия рака прямой кишки: теория и клиническая практика. Семин Онкол . 2006; 33 (5 Приложение 10): S35 – S40. |
145. | Xu L, Pirollo KF, Chang EH. Терапия гена р53, направленная на опухоль, повышает эффективность обычной химио / лучевой терапии. J Управляющая версия . 2001. 74 (1–3): 115–128. |
146. | Лю С., Курцрок Р. Токсичность таргетной терапии: последствия для ответа и влияние генетических полиморфизмов. Лечение рака Ред. . 2014. 40 (7): 883–891. |
147. | Merck and Co, Inc. Ветеринарное руководство Merck . Станция Уайтхаус, Нью-Джерси, США; 2012. |
148. | Уивер А.Д. 15 случаев рака предстательной железы у собак. Ветеринарная запись . 1981; 109 (4): 71–75. |
149. | Хаббард Б.С., Вулгамотт Дж. С., Лиска В. Д.. Аденокарцинома простаты у кошки. J Am Vet Med Assoc . 1990; 197 (11): 1493–1494. |
млекопитающее | Определение, характеристики, классификация и факты
Разнообразие
Эволюция класса Mammalia привела к огромному разнообразию форм и привычек.Живые виды варьируются по размеру от летучей мыши весом менее грамма и крошечных землероек весом всего несколько граммов до самого большого животного, которое когда-либо существовало, синего кита, который достигает длины более 30 метров (100 футов) и веса 180 метрических тонн (почти 200 коротких [США] тонн). Все основные среды обитания использовались млекопитающими, которые плавают, летают, бегают, роют норы, скользят или лазают.
окапиОкапи ( Okapia johnstoni ).
© Steffen Foerster Photography / Shutterstock.com Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасСуществует более 5 500 видов живых млекопитающих, разделенных примерно на 125 семейств и от 27 до 29 отрядов (семейные и порядковые группы иногда различаются в зависимости от авторитетных источников). Грызуны (отряд Rodentia) — самые многочисленные из существующих млекопитающих как по количеству видов, так и по количеству особей, и являются одними из самых разнообразных живых линий. Напротив, отряд Tubulidentata представлен одним живым видом — трубкозубом.Uranotheria (слоны и их родственники) и Perissodactyla (лошади, носороги и их родственники) являются примерами отрядов, в которых в периоды позднего палеогена и неогена (от 30 до 3 миллионов лет назад) было гораздо большее разнообразие, чем сегодня.
Наибольшее современное разнообразие наблюдается в континентальных тропических регионах, хотя представители класса Mammalia обитают на всех основных массивах суши (или в прилегающих к ним морях). Млекопитающие также можно найти на многих океанических островах, которые в основном, но не исключительно, населены летучими мышами.Можно выделить основные региональные фауны; во многом это явилось результатом эволюции сравнительной изоляции стай ранних млекопитающих, достигших этих районов. Южная Америка (Неотропы), например, была отделена от Северной Америки (Неарктика) примерно 65–2,5 миллиона лет назад. Группы млекопитающих, достигшие Южной Америки до разрыва между континентами, или те, которые «перебрались на острова» после разрыва, развивались независимо от родственников, оставшихся в Северной Америке.Некоторые из последних вымерли в результате конкуренции с более развитыми группами, тогда как группы в Южной Америке процветали, некоторые излучались до такой степени, что успешно конкурировали с захватчиками после воссоединения двух континентов. Австралия представляет собой параллельный случай ранней изоляции и адаптивной радиации млекопитающих (в частности, одноплодных и сумчатых), хотя он отличается тем, что Австралия не была впоследствии связана с каким-либо другим материком. Плацентарные млекопитающие, попавшие в Австралию (грызуны и летучие мыши), очевидно, сделали это путем прыжков с островов намного позже, чем адаптивное излучение млекопитающих, выделенных на раннем этапе.
Фаунистические царства и основные регионы мира.
Encyclopædia Britannica, Inc.Напротив, Северная Америка и Евразия (Палеарктика) являются отдельными массивами суши, но имеют тесно связанные фауны в результате того, что они были связаны несколько раз в эпоху плейстоцена (от 2,6 млн до 11700 лет назад) и ранее через Берингов пролив. Их фауны часто считаются представляющими не две отдельные единицы, а одну, связанную в такой степени, что к ней применяется одно название — Голарктика.
Границы | Сирийский хомяк как модель животного для исследования инфекционных заболеваний
Введение
Согласно данным, опубликованным Всемирной организацией здравоохранения (ВОЗ), инфекционные агенты, вызывающие инфекции нижних дыхательных путей, диарейные заболевания и туберкулез, вошли в первую десятку причин смерти во всем мире, в результате чего в 2016 году умерло 5,7 миллиона человек (1). Совершенно очевидно, что нам необходимо улучшить наше понимание этих болезней и патогенных агентов, чтобы разработать более эффективные лекарства и вакцины.Для этого нам нужна подходящая модель на животных, которая может наиболее точно имитировать патогенез инфекции, поскольку инфекция обычно вызывает сложный процесс иммунных ответов хозяина, который в экспериментах in vitro и не удалось смоделировать. Только модели in vivo и могут точно оценить сложность ответов хозяина и позволить оценить эффективность и побочные эффекты лекарств или вакцины.
Сирийский хомяк ( Mesocricetus auratus ) использовался в качестве модели на животных для изучения заболеваний, связанных с человеком, более 60 лет.Ряд исследований документально подтвердил, что сирийские хомяки представляют собой более эффективные модели для анализа вирусных инфекций по сравнению с моделями на мышах, поскольку они больше похожи на людей в отношении симптомов болезни, патогенеза и иммунных реакций (2–4). Нами и другими было продемонстрировано, что человеческие цитокины, в том числе гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) и интерлейкин-12 (IL-12), полностью функциональны на моделях хомяков, но не на моделях мышей (5, 6). Вместе с другими преимуществами, такими как высокая скорость воспроизводства и простота обращения, сирийские хомяки являются лучшим выбором по сравнению с другими мелкими животными.
Хотя сирийские хомяки исторически использовались в исследованиях болезней, их ценность в качестве животной модели при изучении инфекционных заболеваний была осознана только недавно. С развитием технологий редактирования генов их популярность значительно возросла (рис. 1). Использование генно-инженерных моделей сирийского хомяка (GESH) имеет решающее значение для понимания прогрессирования заболевания и разработки режимов профилактического и терапевтического лечения. Первый сирийский хомяк с нокаутом гена STAT2 (KO) был разработан в 2014 году с использованием системы CRISPR / Cas9 для нацеливания на зародышевую линию хомяка (7).STAT2 является ключевым элементом пути передачи сигнала интерферона I типа (IFN), и модель хомяка стала единственной моделью небольших животных, допускающей заражение аденовирусом (AdV), таким образом, модель STAT2 KO имеет решающее значение для характеристики аденовируса. патогенез (8).
Рисунок 1 . Количество публикаций, использующих сирийских хомяков в качестве модели болезни. Показано количество публикаций с использованием сирийских хомяков в качестве модели животных с 1997 по 2017 год.Для каждого стандарта количество публикаций определялось путем поиска с использованием базы данных ScienceDirect. Поиск выполнялся по ключевым словам «сирийский хомяк» или «золотой хомяк» И «модель» И (1) «вирус» или «вирус» (2) «бактерии», (3) «инфекция» или «болезнь».
Сирийский хомяк, используемый для исследования вирусных инфекций
Сирийский хомяк — идеальная модель мелких животных для изучения болезни, вызываемой вирусной инфекцией. Предыдущие исследования показали, что некоторые специфические для человека вирусы также могут инфицировать, реплицироваться и вызывать аналогичные патологические изменения у сирийских хомяков (9).В частности, сирийские хомяки признаны ценной моделью для изучения возникающих и острых вирусных заболеваний человека, вызываемых высокопатогенными РНК-вирусами (10). Таким образом, эти животные представляют большую ценность для тестирования потенциальных вакцин и новых терапевтических препаратов для использования человеком. В настоящее время с использованием сирийского хомячка было исследовано более 70 различных вирусов, и в будущем будут изучены дополнительные исследования вирусных инфекций (таблица 1). В этом обзоре мы сосредоточимся на шести вирусах, для которых использование сирийского хомяка дало ценную информацию о патогенезе болезни.
Таблица 1 . Вирусные инфекции на моделях сирийского хомяка.
Вирус Западного Нила
Наиболее интенсивно изучаемым вирусом сирийских хомячков является вирус Западного Нила (ВЗН). WNV является представителем рода Flavivirus (семейство Flaviviridae ), нового зоонозного арбовируса, широко распространенного во всем мире (38). ЛЗН обычно передается через укусы инфицированных членистоногих (комаров). У людей большинство инфекций ЛЗН протекает бессимптомно, и только у 20% инфицированных развивается симптоматическая лихорадка Западного Нила (ЛЗН) (39).Тем не менее, WNV — это важный развивающийся нейротропный вирус, вызывающий тяжелый энцефалит у человека, представляющий значительную угрозу для здоровья во всем мире (40). Сирийские хомяки могут легко заразиться при укусе комара, проглатывании (пероральном) или прививке иглой, а у инфицированных хомяков развивается виремия и болезнь с симптомами, аналогичными тем, которые наблюдаются при заражении человека (41, 42). Используя эту модель хомяка, Xiao et al. наблюдали как гистологические аномалии, так и появление вирусного антигена в головном мозге, а затем в спинном мозге, причем инфекция в конечном итоге приводила к острому повреждению центральной нервной системы (ЦНС) (13).У инфицированных хомяков развилось неврологическое заболевание (43–46) и связь подавленных диафрагмальных электромиографов (ЭМГ) с инфекцией продолговатого мозга (47). Самуэль и др. также обнаружили, что прививка сирийского хомячка WNV приводила к параличу задней конечности ипсилатеральному, но не контралатеральному месту инъекции (48). Матео и др. создали модель сирийских хомяков с подавленным иммунитетом, используя циклофосфамид, и после заражения у хомяков наблюдались клинические признаки, аналогичные тем, которые наблюдались у пациента с иммунодефицитным раком, инфицированного WNV (49).Наблюдая за патогенезом заболевания у хомяков с ослабленным иммунитетом, инфицированных ВЗН, было показано, что у животных развилась хроническая виремия и продолжалась почечная инфекция в течение 8 месяцев (50). Сирийские хомяки не только демонстрируют адаптивный иммунный ответ, но также обладают врожденным иммунным ответом на инфекцию WNV. Поскольку было показано, что сирийский хомяк является подходящей моделью для инфекции WNV, он также использовался для проверки эффективности нейтрализующего WNV гуманизированного моноклонального антитела hE16 (44). Иммунопрофилактика антител, индуцированная доставкой рекомбинантных антигенов (WN-80E или WN-NS1), также защищала сирийского хомяка от инфекции WNV (51).Используя модель сирийского хомяка, Widman et al. успешно продемонстрировали, что RepliVAX WN, платформа однократной флавивирусной вакцины, способна индуцировать стойкий защитный иммунитет против заражения WNV (52). Эти исследования демонстрируют, что сирийский хомяк является идеальной моделью для изучения патогенеза инфекции WNV и оценки новых подходов к лечению и профилактике WNV.
Вирус желтой лихорадки
YFV является вирусом, переносимым членистоногими, из рода Flavivirus (семейство Flaviviridae ) и имеет высокие показатели заболеваемости и смертности в регионах Африки к югу от Сахары и Южной Америки (53).Это был один из первых вирусов человека, который был идентифицирован, выделен, размножен in vitro и и изучен с помощью геномного секвенирования (54). Изучение механизма заражения YFV исторически затруднялось из-за отсутствия подходящей модели на мелких животных, и обычно использовались модели нечеловеческих приматов (NHP). Совсем недавно несколько исследовательских групп создали модели животных с использованием сирийских хомяков, которые могут быть успешно инфицированы YFV (55–58). McArthur et al. сообщалось, что адаптированные вирусные штаммы (Asibi / hamster p7) позволяют воспроизводить желтую лихорадку у хомяков с признаками, аналогичными болезни человека (59).Кроме того, исследования также показали, что инфекция сирийского хомяка приводит к иммунным ответам, которые соответствуют тем, которые наблюдаются у инфицированных людей, с заметным увеличением IFN-γ, IL-2, TNF-α в селезенке, почках и сердце, но снижается. уровни их наблюдаются в печени. Кроме того, эти исследования обнаружили повышенный уровень IL-10 и снижение уровня TGF-β в печени, селезенке и сердце на ранних и средних стадиях инфекции (60). Сирийского хомяка можно использовать как для изучения патогенеза инфекции YFV, так и для проверки противовирусных препаратов и противовирусной терапии.Недавние открытия показали, что лечение антивирусными соединениями 2′-C-метилцитидином (61), T-1106 (62), IFN alfacon-1 (63) и BCX4430 (64) до и после воздействия YFV может значительно улучшить выживаемость сирийских хомяков. В исследовании Julander et al. иммунизация DEF201, вектором AdV типа 5, экспрессирующим IFN-альфа (IFN-α), может эффективно снижать титр вируса в печени хомяка и сыворотке после инфицирования YFV (65). Иммунопрофилактика с помощью XRX-001, вакцины, содержащей инактивированный антиген желтой лихорадки с квасцовым адъювантом, может вызвать высокие титры нейтрализующих антител in vivo для защиты сирийских хомячков от инфекции YFV (66, 67).Интересно, что Xiao et al. (67) и Tesh et al. (68) демонстрируют, что предшествующее воздействие на сирийских хомяков гетерологичных флавивирусов снижает риск инфекции YFV.
Нипах Вирус
Nipah — парамиксовирус из рода , Henipavirus (семейство Paramyxoviridae ) с высоким уровнем летальности (69). Инфекция у людей обычно вызывает тяжелые энцефалиты и респираторные заболевания (70). После инокуляции вирусом Нипах (NiV) у сирийских хомячков также развивается характерное неврологическое заболевание (12).Подобно симптомам после инфицирования человека, наиболее тяжелые и обширные патологические поражения проявляются в головном мозге хомячка и вирусном антигене, а РНК можно обнаружить в нейронах (11), легких (71), почках и селезенке (11). Сирийских хомяков в большинстве исследований инфекции NiV лечат путем внутрибрюшинной (IP) инъекции или интраназальной (IN) доставки, и эти модели показали, что разные методы прививки могут вызывать различные патологические реакции (11). В работе Вонга внутрибрюшинная инъекция NiV сирийским хомячкам вызывала в первую очередь неврологическое заболевание, тогда как при доставке IN развивались неврологические симптомы, а также затрудненное дыхание из-за инфекции легких на последних стадиях заболевания (11).Заболевание обычно прогрессирует очень быстро, и время до смерти после инфицирования короче после внутрибрюшинной, а не интраназальной инокуляции (72). Поскольку сирийский хомяк показал свою пригодность для изучения инфекции NiV, его в дальнейшем использовали для изучения передачи вируса (73–75), продемонстрировав, что вирус Nipah эффективно передается через прямой контакт, а неэффективно через фомиты, но не через аэрозоли. Что касается использования этих моделей для разработки лечения и профилактики заболеваний, недавние исследования показали, что предварительная обработка поли (I) -поли (C 12 U) может значительно снизить смертность сирийского хомяка от NiV-инфекции (76).Кроме того, модель использовалась в качестве платформы для оценки вакцин против NiV (77–80). Walpita et al. обнаруженные очищенные NiV-подобные частицы (VLP) могут защитить сирийского хомяка с использованием схем вакцинации с использованием нескольких доз или однократной вакцинации с последующей заражением NiV (81).
Вирус Эбола
Вирус Эбола (EBOV) — один из пяти известных вирусов в пределах рода Ebolavirus (семейство Filoviridae ) (10). Он классифицируется ВОЗ как патоген 4 уровня биобезопасности (BSL-4).Сирийские хомяки не только могут быть эффективно инфицированы мышиным адаптированным (MA) -EBOV, они также обладают основными признаками инфекции и патогенеза, наблюдаемыми у людей и нечеловеческих приматов (NHP). Сирийские хомяки могут быть привиты с помощью внутрибрюшинной инъекции вируса Эбола Заира, адаптированного для мышей (MA-ZEBOV). Патология, вызванная этой инфекцией, аналогична патологии человека, которая включает значительное повреждение селезенки и печени, нарушение регуляции цитокинов, тяжелую коагулопатию, апоптоз лимфоцитов и некроз или апоптоз инфицированного органа (21, 82).Иммунные ответы инфицированных сирийских хомяков включают активацию Т-лимфоцитов и выработку антител. В недавнем исследовании результаты заражения хомяков вирусом Эбола показали, что CD4 + Т-клетки необходимы для естественного иммунитета, а CD4-зависимые ответы антител необходимы для иммунитета против вируса в этой модели (83). Сирийских хомяков можно использовать для оценки бивалентной вакцины, содержащей рекомбинантный вирус везикулярного стоматита (VSV), экспрессирующий два разных иммуногена, полученных из гликопротеина оболочки ZEBOV (84) и вируса Анд (ANDV) (32).Результаты показали, что однократная иммунизация этой вакциной обеспечивает хомякам полную и стерильную защиту от летального заражения MA-ZEBOV или ANDV (85).
Марбургский вирус
ВирусМарбург (MARV) также является вирусом с отрицательной смысловой РНК, принадлежащим к семейству Filoviridae , который вызывает геморрагическую лихорадку (86). Исследователи показали, что сирийских хомяков можно использовать для изучения инфекции MARV. Модель сирийского хомяка была создана для изучения инфекции MARV с использованием ангольского варианта (HA-MARV) (22).В исследовании у хомяков, инокулированных HA-MARV, развились геморрагические проявления, нарушения свертывания крови, нарушение регуляции провоспалительных хемокинов MIP-1α и IP-10 и увеличение ответа на интерферон I типа (22, 87). Кроме того, Аткинс и др. недавно разработали модель небольшого животного для инфекции MARV дикого типа с использованием STAT2 KO сирийского хомяка, в которой вирусная репликация быстро прогрессирует до полиорганной инфекции и обширной виремии (23), демонстрируя, что STAT2 является ключевым фактором хозяина, влияющим на инфекцию MARV дикого типа.
Вирус лихорадки Рифт-Валли
RVFV является представителем семейства Bunyaviridae и рода Phlebovirus (88, 89). RVFV обычно передается через укусы инфицированных комаров и может привести к легкому фебрильному заболеванию, ретиниту, фульминантному гепатиту, энцефалиту и вирусной геморрагической лихорадке (90). Инфекция RVFV у сирийских хомяков хорошо описана (91). Результаты исследования оценили восприимчивость сирийских хомяков к инфекции RVFV и показали, что вирусная инфекция приводит к виремии, повышению вирусной нагрузки в тканях печени, мозга и селезенки, наблюдению тяжелого гепатоцеллюлярного некроза на ранней стадии инфекции и высокой иммунореактивности. пораженных гепатоцитов (27, 92, 93).Кроме того, используя сирийских хомяков, Scharton et al. доказано, что профилактический препарат Фавипиравир (Т-705) может эффективно защитить инфицированных лиц от инфекции RVFV и уменьшить неврологические заболевания с отсроченным началом, наблюдаемые при лечении рибавирином (94). В другом исследовании Gowen et al. использовали хомяков, чтобы продемонстрировать защиту от инфекции с помощью интраназального введения однократной дозы вектора AdV-IFNα DEF201 (95). Кроме того, результаты, представленные Westover et al. демонстрируют, что аналог аденозина галидесивир (BCX4430) может эффективно снижать титр RVFV у инфицированных сирийских хомяков (96).
Другие вирусы
Большое количество других исследований также продемонстрировало, что сирийский хомяк является допустимой моделью для мелких животных для других вирусов, например, модель сирийского хомяка была успешно использована для проверки эффективности анти-F MAb для снижения инфицирования вирусом Хендра (12). STAT2 KO. Сирийский хомяк показал успешное заражение вирусом Зика (ZIKV), и у инфицированных хомяков наблюдались те же симптомы, что и у человека (15). Кроме того, сирийский хомяк с подавленным иммунитетом, созданный Schaecher et al.усилило его ценное применение при изучении коронавирусной инфекции тяжелого острого респираторного синдрома (SARS-CoV) (34). Сирийский хомяк успешно охарактеризован на предмет заражения гриппом человека, включая недавно появившиеся вирусы h2N1, pdm09 и h4N2 (97). Более того, в качестве разрешающей иммунокомпетентной животной модели для изучения онколитического аденовируса его использование расширяется для изучения виротерапии рака (98–100).
Сирийский хомяк, используемый для исследования бактериальных и паразитарных инфекций
Сирийский хомяк также является идеальной животной моделью для изучения ряда бактериальных и паразитарных инфекций человека, и о его применении хорошо сообщалось в литературе (таблица 2).Среди изученных патогенов некоторые, такие как бабезиоз, лептоспироз и лейшманиоз, могут вызывать смертельную инфекцию. Что касается исследований патогенеза вирусов, ценность модели сирийского хомяка отражается не только в изучении патологического и иммунного ответа на эти инфекции, но и в открытии потенциальных лекарств и методов лечения.
Таблица 2 . Основные исследования бактериальных и паразитарных инфекций у сирийского хомяка.
Leptospira interrogan
Патогенные Leptospira interrogans — это спирохетные бактерии, вызывающие лептоспироз, широко распространенный и вновь появляющийся запущенный зооноз.Сирийский хомяк является предпочтительной моделью для изучения инфицирования сероваров Leptospira interrogans , при котором бактерии быстро попадают в кровоток через лимфатические сосуды, затем вторгаются в ткани и заражают все органы до смерти хомяков (108). Как и у человека, присутствие Leptospira interrogans может быть обнаружено в печени и почках с разрушением соединений гепатоцитов, что приводит к желтухе, тромботической гломерулопатии и интерстициальному нефриту (109, 110).У инфицированных животных развивается повышенная экспрессия провоспалительных цитокинов клетками периферической крови, таких как IL-1α, IL-10, TNF-α (111). Резкий дисбаланс в продукции цитокинов при инфекции Leptospira может играть важную роль в развитии тяжелого лептоспироза (112). Поскольку было показано, что сирийский хомяк является подходящей моделью, его использовали для проверки эффективности вакцин против этого заболевания. Palaniappan et al. демонстрируют, что иммунизация сирийского хомяка рекомбинантным LigA (rLigA) предотвращает летальные исходы, снижает гистопатологические поражения в почках и подавляет рост организмов (113).В другом исследовании вакцина с использованием консервативной области лептоспирального иммуноглобулиноподобного белка B (LigB, 131–645) и гидроксида алюминия (AH) может значительно повысить уровни IgG и IgM у хомяка, защищая животное от смертности после заражения ( 114).
Clostridium difficile
Clostridium difficile Заболевание, вызванное Clostridium difficile Инфекция (CDI), является одним из наиболее распространенных инфекционных заболеваний во всем мире (115).Возрастающая угроза заболеваемости и смертности, вызванная инфекцией, в основном связана с появлением гипервирулентных штаммов, увеличением и неправильным использованием антибиотиков (116). Использование модели мышей на животных не привело к открытиям лекарств от ИКД, поэтому необходимо найти новые модели на животных (117, 118). Несколько групп создали модели сирийского хомяка для ИКД, у которых развились многие клинические симптомы, наблюдаемые у инфицированных людей (119–121). В этих исследованиях сирийских хомяков кондиционировали однократной подкожной инъекцией клиндамицина, чтобы вызвать модель колита Clostridium difficile .Используя эту модель инфекции, была оценена эффективность антибиотика LFF571 против Clostridium difficile (122), а также была протестирована пероральная смесь выделенных кефиром бактерий и дрожжей для предотвращения диареи и энтероколита, вызванного Clostridium difficile (123).
Leishmania donovani
Висцеральный лейшманиоз (VL; также известный как кала-азар) является наиболее тяжелой формой лейшманиоза, вызываемой Leishmania donovani и Leishmania infantum ( Leishmania chagasi в Америке) (124).Сирийский хомяк очень восприимчив к заражению висцерализующими видами Leishmania и считается лучшей экспериментальной моделью для изучения ВЛ, поскольку он воспроизводит клинико-патологические особенности человеческого заболевания и весьма отличается от тех, которые отмечены в мышиных моделях инфекции (125). В большинстве исследований животные заражались внутрикардиальным путем. У инфицированных животных наблюдается повышенная экспрессия мРНК Th2-ассоциированных цитокинов, таких как IFN-γ, IL-2 и TNF-α, в селезенке, но ограниченная индукция мРНК IL-4 (126).В моделях на мышах, Leishmania контролируется посредством образования оксида азота (NO), однако у хомяков, как и у людей, NO не играет роли в функции макрофагов. МРНК индуцируемой NO-синтетазы (iNOS) не была обнаружена в печени или селезенке хомяков, что может объяснить неконтролируемую репликацию паразитов, происходящую у хомяков и людей, несмотря на индукцию сильного цитокинового ответа Th2 (126). Модель сирийского хомяка может использоваться не только для изучения патогенеза инфекции Leishmania donovani , но и для тестирования вакцин, как показали недавние исследования.Kushawaha et al. использовали модель сирийского хомяка, чтобы показать, что рекомбинантная протеин-дисульфидизомераза Leishmania donovani (rLdPDI) вырабатывала устойчивый клеточный иммунный ответ с повышенной транскрипцией iNOS и уровнями TNF-α, IFN-γ и IL-12 (127). В другом исследовании Samant et al. вакцинация ДНК-кодирующим N-концевым доменом гена PPG у золотистых хомяков дала 80% защиту от заражения Leishmania donovani с генерацией иммунного ответа типа Th2 (128).
Leishmania infantum
Помимо Leishmania donovani, Leishmania infantum также изучалась с использованием модели сирийского хомяка. Moreira et al. создали модель с использованием сирийских хомяков, демонстрирующую аналогичную клиническую картину у человека на инфекции Leishmania infantum (129). У животных развилась гепатоспленомегалия, резкое похудание, анемия и лейкопения. Исследование показало повышенный уровень IgG у хомяков, инфицированных Leishmania infantum (130).Подобно людям, у сирийских хомяков может развиться прогрессирующее смертельное заболевание, при этом основными местами размножения паразитов являются печень, селезенка и костный мозг, что в конечном итоге приводит к гибели хозяина (131). Заражение хомяков показало сильный гуморальный ответ против антигенов Leishmania и высокие уровни антител (131). В ходе исследования был протестирован белок LJM19 (иммунизация 16 ДНК-плазмидами, кодирующими белки слюны Lu. Longipalpis ), защищавший хомяков от летального исхода VL (132).
Entamoeba histolytica
Entamoeba histolytica — популярный простейший паразит, вызывающий амебиаз у людей, который является основным источником заболеваемости и смертности в развивающихся странах (133). Паразитарный Entamoeba histolytica вызывает амебный колит и амебный абсцесс печени (ALA). Сирийский хомяк может быть успешно инфицирован Entamoeba histolytica (104). Подобно симптомам после заражения человека, основное внекишечное осложнение, АЛК, также обнаруживается у хомяков.У хомяка привлечение нейтрофилов в печень является первоначальным ответом хозяина на инфекцию Entamoeba histolytica (134). Исследование показало, что лейкоциты могут вызывать клеточную гибель Entamoeba histolytica трофозоитов (135). Хотя существует антипаразитарный препарат (метронидазол), у пациентов наблюдаются побочные эффекты токсичности; таким образом, эта модель была использована для разработки альтернативных терапевтических агентов. Одна исследовательская группа показала, что бычий лактоферрин защищает от печеночного амебиаза на модели сирийского хомяка (136).Хомяков также использовали, чтобы показать, что внутрибрюшинная инъекция поверхностной металлопротеазы Entamoeba histolytica (EhMSP-1), антигенной вакцины, защищает от амебных абсцессов печени (137). В этом исследовании иммунизация EhMSP-1 стимулировала устойчивый ответ антител IgG, IgG связывался с поверхностью трофозоитов Entamoeba histolytica и ускорял амебный лизис через активацию классического каскада комплемента. Та же самая животная модель, которая использовалась для инфекции Entamoeba histolytica , была использована, чтобы показать, что бакуловирус, управляющий экспрессией фрагмента Gal-Lectin LC3, при внутримышечной инъекции увеличивал уровни IFN-γ и IL-4 в печени для защиты от ALA (138 ).
Schistosoma haematobium
Schistosoma haematobium (мочевой кровяной сосальщик) является этиологическим агентом урогенитального шистосомоза, источником заболеваемости и смертности более 112 миллионов человек во всем мире (139). Хотя улучшенная модель инфекции мочевыводящих путей S. haematobium на мышах может повторять некоторые аспекты урогенитального шистосомоза человека (139), сирийские хомяки все же демонстрируют преимущества по сравнению с мышами. Сирийские хомяки могут быть трансдермально инфицированы Schistosoma haematobium cercariae (140, 141).Модель с Schistosoma haematobium cercariae granulomatous-like иммунной реакцией и инфекцией фиброза печени с использованием сирийских хомяков была создана Botelho et al. (142). Botros et al. использовали модель сирийского хомяка для анализа и тестирования лечения празиквантелом (PZQ) (143). Эта животная модель выявила преобладающие CD4 + Т-клетки в острой фазе формирования гранулемы в печени [75 дней после инфицирования (PI)]. Сливающиеся гранулемы с множеством яиц в центре наблюдались в печени и мочевом пузыре с преобладание CD8 + положительных Т-клеток в печени (95 и 115 дней ИП).В этой модели высокая доза PZQ явно излечивала после 75 дней ИП.
Другое
Существует множество исследований, детализирующих патогенез других бактерий и паразитарных инфекций с использованием модели сирийского хомяка на животных, которые нельзя здесь подробно обсуждать. Модель сирийского хомяка для изучения инфекции Borrelia burgdorferi была создана Johnson et al. (144). После заражения Borrelia burgodrferi хомяков использовали для изучения суставных проявлений боррелиоза Лайма, аналогичного человеческому (145).Сирийский хомяк может быть успешно инфицирован Leishmania panamensis (146). У инфицированных животных наблюдается повышенная экспрессия цитокинов типа II (IL-4 и IL-13), пониженная регуляция IL-12 и повышенная регуляция хемокина типа II CCL17 и его рецептора CCR4 в лимфатическом узле. Grogl et al. создал модель с использованием сирийских хомяков для открытия лекарств от инфекции Leishmania panamesis (147). После заражения Leishmania braziliensis Ribeiro-Romao et al. наблюдали большие и изъязвленные поражения с повышенными уровнями интерферона-γ и фактора некроза опухоли (TNF) во время конечной точки инфекции, что предполагает, что эти цитокины способствуют повреждению тканей (148).Лечение инфекции Leishmania amazonensis путем внутриочагового введения диметилкарбапорфирина кеталя (CKOMe) уменьшало паразитарную нагрузку без заметных токсических эффектов в печени (149). Модель сирийского хомяка для изучения инфекции Plasmodium berghei (150) продемонстрировала индукцию тяжелой малярии на модели оконной камеры сирийского хомяка и была использована для исследования изменений микроциркуляции и оксигенации тканей (151). Для получения дополнительной информации об использовании моделей сирийского хомяка для исследования этих инфекций читатель может обратиться к соответствующим публикациям.
Заключительные замечания
В этом обзоре мы описали использование модели сирийского хомяка как чрезвычайно эффективную и актуальную платформу для оценки молекулярных механизмов иммунного ответа на инфекционные заболевания. Эти исследования сосредоточены на нескольких инфекционных патогенах, в том числе вирусного, паразитарного и бактериального происхождения. Результаты показывают, что иммунный ответ сирийского хомяка более физиологичен, чем иммунный ответ человека, по сравнению с иммунным ответом других животных, что дает уникальные преимущества при изучении патогенеза заболевания и открытии новых лекарств и методов лечения.В будущих исследованиях следует рассмотреть возможность определения дополнительных сходств между активацией иммунного ответа сирийского хомяка и человека посредством манипулирования патогенами метаболизма хозяина. Расширенные исследовательские усилия в конечном итоге позволят разработать новые технологии и инструменты для изучения сирийского хомяка, такие как технология более точного секвенирования вместе со специфическими антителами против белков хомяка, которые в настоящее время ограничены по сравнению с аналогичными инструментами для изучения реакции мышей на инфекцию.Мы считаем, что недавние достижения модели сирийского хомяка внесли огромный вклад в наше понимание инфекционных заболеваний и методов борьбы с ними и демонстрируют большой потенциал для будущих исследований и разработки противовирусных лекарств.
Однако, как уже говорилось, отсутствие инструментов исследования представляет собой серьезное препятствие для эффективного использования моделей сирийского хомяка. Иммунологические реагенты для исследования иммунного ответа хозяина и экспрессии конкретных генов, а также модели трансгенных заболеваний потребуются для более полной оценки ценности этой модели.Чтобы преодолеть это, исследовательские группы разрабатывают или идентифицируют значительное количество антител против сирийского хомяка (таблица 3), а также были разработаны специфичные для хомяков количественные ПЦР в реальном времени (RT-qPCR), анализ транскриптома и микроматрицы (169). Самое поразительное, что технология CRISPR / Cas9 быстро ускорила создание трансгенных моделей болезни сирийского хомяка (170). Эти инструменты позволят преодолеть ограничения на исследования с использованием сирийских хомяков, открыв мощную платформу для анализа патогенов человека.
Таблица 3 . Список антител, проверенных на сирийском хомяке.
Авторские взносы
JM, ZW и YW: концепция и дизайн рукописи. JM: написание рукописи. LC, ZW и YW: редактирование рукописи.
Финансирование
Этот проект поддерживается Национальной ключевой программой исследований и разработок Китая (2016YFE0200800), Хэнаньским университетом китайской медицины (грант № 00104358), Национальным фондом естественных наук Китая (грант № 81472854 для ZW) и MRC (MR / N027655 / 1 и MR / M015696 / 1 в LC и YW).
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
2. Огг М., Йонссон К. Б., Кэмп-СП, Хупер Дж. У. Рибавирин защищает сирийских хомяков от летального хантавирусного легочного синдрома после интраназального воздействия вируса Анд. Вирусы. (2013) 5: 2704–20. DOI: 10.3390 / v5112704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3.Прескотт Дж., ДеБайсчер Б.Л., Браун К.С., Фельдманн Х. Долгосрочная эффективность однократной дозы вакцины против вируса Анд на основе вируса везикулярного стоматита у сирийских хомяков. Вирусы. (2014) 6: 516–23. DOI: 10.3390 / v6020516
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Zu Rhein GM. Исследования опухолей нервной системы, вызванных вирусом JC, у сирийского хомяка: обзор. Prog Clin Biol Res. (1983) 105: 205–21.
PubMed Аннотация | Google Scholar
5.Чо С.А., Пак Дж. Х., Сеок С. Х., Джун Дж. Х., Ким С. Дж., Джи Х. Дж. И др. Эффект гранулоцитарного макрофагально-колониестимулирующего фактора (GM-CSF) на 5-FU-индуцированный язвенный мукозит в буккальных мешках хомяков. Exp Toxicol Pathol. (2006) 57: 321–8. DOI: 10.1016 / j.etp.2005.09.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Ван П., Ли Х, Ван Дж, Гао Д., Ли И, Ли Х и др. Переработка интерлейкина-12 для повышения его безопасности и потенциала в качестве противоопухолевого иммунотерапевтического агента. Nat Commun. (2017) 8: 1395. DOI: 10.1038 / s41467-017-01385-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Fan Z, Li W, Lee SR, Meng Q, Shi B, Bunch TD и др. Эффективное нацеливание на гены у золотистых сирийских хомяков с помощью системы CRISPR / Cas9. PLoS ONE. (2014) 9: e109755. DOI: 10.1371 / journal.pone.0109755
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Тот К., Ли С. Р., Ин Б., Спенсер Дж. Ф., Толлефсон А. Э., Сагарц Дж. Э. и др.Сирийские хомяки с нокаутом STAT2 поддерживают усиленную репликацию и патогенность аденовируса человека, что свидетельствует о важной роли реакции интерферона I типа в борьбе с вирусами. PLoS Pathog. (2015) 11: e1005084. DOI: 10.1371 / journal.ppat.1005084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Уокер Д.Л., Паджетт Б.Л., Зурейн Г.М., Альберт А.Е., Марш РФ. Паповавирус человека (JC): индукция опухолей головного мозга у хомяков. Наука. (1973) 181: 674–6.DOI: 10.1126 / science.181.4100.674
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Валь-Йенсен В., Боллинджер Л., Сафронец Д., де Кок-Меркадо Ф., Скотт Д. П., Эбихара Х. Использование сирийского хомяка в качестве новой модели болезни, вызванной вирусом Эбола, и других вирусных геморрагических лихорадок. Вирусы. (2012) 4: 3754–84. DOI: 10.3390 / v4123754
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Вонг К.Т., Грожан И., Бриссон С., Бланкье Б., Февр-Монтанж М., Бернар А. и др.Модель золотого хомяка для острой инфекции вируса Нипах у человека. Am J Pathol. (2003) 163: 2127–37. DOI: 10.1016 / S0002-9440 (10) 63569-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Гийом В., Вонг К.Т., Луи Р.Ю., Жорж-Курбот М.С., Барро Л., Бакленд Р. и др. Острая инфекция вирусом Хендра: анализ патогенеза и пассивной защиты антител на модели хомяка. Вирусология. (2009) 387: 459–65. DOI: 10.1016 / j.virol.2009.03.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Сяо С.Ю., Гусман Х., Чжан Х., Травассос да Роса А.П., Теш РБ. Инфекция вируса Западного Нила у золотого хомяка ( Mesocricetus auratus ): модель энцефалита Западного Нила. Emerg Infect Dis. (2001) 7: 714–21. DOI: 10.3201 / eid0704.010420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Сиддхартан В., Ван Веттер А. Дж., Ли Р., Мяо Дж., Ван З., Морри Дж. Д. и др. Инфекция вирусом Зика взрослых и эмбриональных хомяков с нокаутом STAT2. Вирусология. (2017) 507: 89–95. DOI: 10.1016 / j.virol.2017.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Сиирин М.Т., Дуан Т., Лей Х., Гусман Х., да Роса А.П., Уоттс Д.М. и др. Инфекция вируса хронического энцефалита Сент-Луиса у золотистого хомяка ( Mesocricetus auratus ). Am J Trop Med Hyg. (2007) 76: 299–306. DOI: 10.4269 / ajtmh.2007.76.299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Боско-Лаут А., Мейсон Дж., Боуэн Р.Патогенез инфекции вируса японского энцефалита на модели золотого хомяка и оценка перекрестного защитного иммунитета от флавивирусов. Am J Trop Med Hyg. (2011) 84: 727–32. DOI: 10.4269 / ajtmh.2011.11-0012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Карарра А.С., Анищенко М., Паесслер С., Аронсон Дж., Уивер С.К., Агилар П. и др. Хомяк как животная модель энцефалита восточных лошадей — и его использование в исследованиях проникновения вируса в мозг. J Infect Dis. (2004) 189: 2072–6. DOI: 10.1086 / 383246
CrossRef Полный текст | Google Scholar
19. Джексон А.С., СенГупта СК, Смит Дж. Ф. Патогенез инфицирования вирусом венесуэльского энцефалита лошадей у мышей и хомяков. Vet Pathol. (1991) 28: 410–8. DOI: 10.1177 / 0300985800509
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Джуландер Дж. Г., Сиддхартан В., Блатт Л. М., Шафер К., Сидвелл Р. В., Морри Дж. Д.. Влияние экзогенного интерферона и индуктора интерферона на вирусное заболевание западного конского энцефалита на модели хомяка. Вирусология. (2007) 360: 454–60. DOI: 10.1016 / j.virol.2006.10.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Эбихара Х., Зивчек М., Гарднер Д., Фальзарано Д., Лакасс Р., Розенке Р. и др. Модель сирийского золотого хомяка, воспроизводящая геморрагическую лихорадку Эбола. J Infect Dis. (2013) 207: 306–18. DOI: 10.1093 / infdis / jis626
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Марзи А., Банадыга Л., Пикша Э., Томас Т., Шен К., Хорн Э. Дж. И др.Модель марбургского вируса на хомяке точно воспроизводит марбургскую геморрагическую лихорадку. Научный доклад (2016) 6: 39214. DOI: 10.1038 / srep39214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Аткинс К., Мяо Дж., Калверам Б., Джулич Т., Смит Дж. К., Перес Д. и др. Естественная история и патогенез инфекции вирусом Марбург дикого типа у хомяков, нокаутированных по STAT2. J Infect Dis. (2018) 218: S438–47. DOI: 10.1093 / infdis / jiy457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24.Shepherd AJ, Leman PA, Swanepoel R. Виремия и ответ антител мелких африканских и лабораторных животных на вирусную инфекцию крымско-конголезской геморрагической лихорадки. Am J Trop Med Hyg. (1989) 40: 541–7. DOI: 10.4269 / ajtmh.1989.40.541
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Сми Д.Ф., Гилберт Дж., Леонхардт Дж. А., Барнетт Б. Б., Хаггинс Дж. Х., Сидвелл Р. У. Лечение летальных инфекций вируса Pichinde у хомячков LVG / Lak после отъема с помощью рибавирина, рибамидина, селеназофурина и амплигена. Antiviral Res. (1993) 20: 57–70. DOI: 10.1016 / 0166-3542 (93)
-R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Кэмпбелл К.Л., Филлипс А.Т., Рико А., Макгуайр А., Абойлэйл Т.А., Квакенбуш С. и др. Участие провоспалительных макрофагов в патологии печени сирийских хомяков, инфицированных вирусом Pirital. Вирусы. (2018) 10: E232. DOI: 10.3390 / v10050232
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27.Никлассон Б.С., Мидорс Г.Ф., Петерс С.Дж. Активная и пассивная иммунизация сирийских хомяков против вируса лихорадки Рифт-Валли. Acta Pathol Microbiol Immunol Scand C. (1984) 92: 197–200. DOI: 10.1111 / j.1699-0463.1984.tb00074.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Вестовер Дж. Б., Ригас Дж. Д., Ван Веттер А. Дж., Ли Р., Хикерсон Б. Т., Юнг К. Х. и др. Инфекция, вызванная вирусом Heartland, у хомяков, у которых отсутствует передача сигналов интерферона I типа: затяжное течение болезни улучшается после приема фавипиравира. Вирусология. (2017) 511: 175–83. DOI: 10.1016 / j.virol.2017.08.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Андерсон GW мл., Slayter MV, Hall W, Peters CJ. Патогенез флебовирусной инфекции (вирус Пунта Торо) у золотистых сирийских хомяков. Arch Virol. (1990) 114: 203–12. DOI: 10.1007 / BF01310749
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Гоуэн Б. Б., Вестовер Дж. Б., Мяо Дж., Ван Веттер А. Дж., Ригас Дж. Д., Хикерсон Б. Т. и др.Моделирование тяжелой лихорадки с вирусной инфекцией синдрома тромбоцитопении у золотистых сирийских хомяков: важность STAT2 в профилактике заболеваний и эффективном лечении фавипиравиром. J Virol. (2017) 91: e01942-16. DOI: 10.1128 / JVI.01942-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Milazzo ML, Eyzaguirre EJ, Molina CP, Fulhorst CF. Мапоральная вирусная инфекция у сирийского золотого хомячка: модель хантавирусного легочного синдрома. J Infect Dis. (2002) 186: 1390–5. DOI: 10.1086 / 344735
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Schaecher SR, Stabenow J, Oberle C, Schriewer J, Buller RM, Sagartz JE, et al. Модель сирийского золотого хомяка с иммуносупрессией на инфекцию SARS-CoV. Вирусология. (2008) 380: 312–21. DOI: 10.1016 / j.virol.2008.07.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Спенсер Дж. Ф., Сагарц Дж. Э., Уолд В. С., Тот К. Новая модель карциномы поджелудочной железы для изучения онколитических аденовирусов у разрешающего сирийского хомяка. Cancer Gene Ther. (2009) 16: 912–22. DOI: 10.1038 / cgt.2009.36
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Мяо Дж., Инь Б., Ли Р., Толлефсон А. Э., Спенсер Дж. Ф., Уолд WSM и др. Характеристика N-концевого неосновного домена гена RAG1 нарушила модель сирийского хомяка, созданную с помощью CRISPR Cas9. Вирусы. (2018) 10: 243. DOI: 10.3390 / v10050243
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Horiuchi M, Priola SA, Chabry J, Caughey B.Взаимодействия между гетерологичными формами прионного белка: связывание, ингибирование конверсии и видовые барьеры. Proc Natl Acad Sci USA. (2000) 97: 5836–41. DOI: 10.1073 / pnas.110523897
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Сбрана Э, Тонри Дж. Х., Сяо С. Ю., да Роса А. П., Хиггс С., Теш РБ. Оральная передача вируса Западного Нила на модели хомяка. Am J Trop Med Hyg. (2005) 72: 325–9. DOI: 10.4269 / ajtmh.2005.72.325
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Морри Дж. Д., Дэй С. В., Джуландер Дж. Г., Олсен А. Л., Сидвелл Р. У., Чейни С. Д. и др. Моделирование хомяков для оценки лечения вирусом Западного Нила. Antiviral Res. (2004) 63: 41–50. DOI: 10.1016 / j.antiviral.2004.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Морри Дж. Д., Сиддхартан В., Олсен А. Л., Ван Х, Джуландер Дж. Г., Холл Дж. О. и др. Определение пределов лечения гуманизированными нейтрализующими моноклональными антителами для неврологической инфекции вируса Западного Нила на модели хомяка. Противомикробные агенты Chemother. (2007) 51: 2396–402. DOI: 10.1128 / AAC.00147-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Морри Дж. Д., Сиддхартан В., Ван Х, Холл Дж. О., Скирпстунас Р. Т., Олсен А. Л. и др. Острый вялый паралич, вызванный вирусом Западного Нила, можно предотвратить с помощью лечения моноклональными антителами, которые вводятся после инфицирования нейронов спинного мозга. J Neurovirol. (2008) 14: 152–63. DOI: 10.1080 / 13550280801958930
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Сиддхартхан В., Ван Х, Моттер Н. Э., Холл Дж. О., Скиннер Р. Д., Скирпстунас Р. Т. и др. Стойкий вирус Западного Нила, связанный с неврологическими последствиями у хомяков, идентифицированный с помощью оценки количества двигательных единиц. J Virol. (2009) 83: 4251–61. DOI: 10.1128 / JVI.00017-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Морри Дж. Д., Сиддхартан В., Ван Х, Холл Дж. О., Моттер Н. Э., Скиннер Р. Д. и др. Неврологическое подавление диафрагменных электромиографов у хомяков, инфицированных вирусом Западного Нила. J Neurovirol. (2010) 16: 318–29. DOI: 10.3109 / 13550284.2010.501847
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Самуэль М.А., Ван Х., Сиддхартхан В., Морри Дж. Д., Diamond MS. Транспорт аксонов опосредует проникновение вируса Западного Нила в центральную нервную систему и вызывает острый вялый паралич. Proc Natl Acad Sci USA. (2007) 104: 17140–5. DOI: 10.1073 / pnas.0705837104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Матео Р., Сяо С.Ю., Гусман Х., Лей Х., Да Роса А.П., Теш РБ. Влияние иммуносупрессии на вирусную инфекцию Западного Нила у хомяков. Am J Trop Med Hyg. (2006) 75: 356–62. DOI: 10.4269 / ajtmh.2006.75.356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Теш Р. Б., Сиирин М., Гусман Х., Травассос да Роса А. П., Ву Х, Дуан Т. и др. Персистирующая инфекция вируса Западного Нила у золотого хомяка: исследования ее механизма и возможных последствий для других флавивирусных инфекций. J Infect Dis. (2005) 192: 287–95. DOI: 10.1086 / 431153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Сиирин М.Т., Травассос да Роса А.П., Ньюман П., Уикс-Леви С., Коллер Б.А., Сяо С.Ю. и др. Оценка эффективности рекомбинантной субъединичной вакцины Западного Нила у сирийских золотых хомяков Am J Trop Med Hyg . (2008) 79: 955–62. DOI: 10.4269 / ajtmh.2008.79.955
CrossRef Полный текст | Google Scholar
52. Видман Д.Г., Исикава Т., Винкельманн Э.Р., Инфанте Э, Борн Н., Мейсон П.В.RepliVAX WN, одноцикловая вакцина против флавивируса для предотвращения болезни Западного Нила, вызывает у хомяков прочный защитный иммунитет. Вакцина. (2009) 27: 5550–3. DOI: 10.1016 / j.vaccine.2009.07.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Клитинг Р., Рот Л., Рей Ф.А., де Ламбаллери X. Молекулярные детерминанты патогенности вируса желтой лихорадки у сирийских золотых хомяков: одна мутация от вирулентности. Emerg Microbes Infect. (2018) 7:51.DOI: 10.1038 / s41426-018-0053-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Сбрана Е., Сяо С.Ю., Попов В.Л., Ньюман П.С., Теш РБ. Экспериментальная инфекция вируса желтой лихорадки у золотистого хомяка ( Mesocricetus auratus ) III. Клинические лабораторные показатели. Am J Trop Med Hyg. (2006) 74: 1084–9. DOI: 10.4269 / ajtmh.2006.74.1084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Теш Р. Б., Гусман Х., да Роса А. П., Васконселос П. Ф., Диас Л. Б., Баннелл Дж. Э. и др.Экспериментальная инфекция вируса желтой лихорадки золотого хомячка ( Mesocricetus auratus ). I. Вирусологические, биохимические и иммунологические исследования. J Infect Dis. (2001) 183: 1431–6. DOI: 10.1086 / 320199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Сяо С.Ю., Чжан Х., Гузман Х., Теш РБ. Экспериментальная инфекция вируса желтой лихорадки золотого хомячка ( Mesocricetus auratus ). II. Патология. J Infect Dis. (2001) 183: 1437–44.DOI: 10.1086 / 320200
CrossRef Полный текст | Google Scholar
59. McArthur MA, Suderman MT, Mutebi JP, Xiao SY, Barrett AD. Молекулярная характеристика висцеротропного штамма вируса желтой лихорадки хомяка. J Virol. (2003) 77: 1462–8. DOI: 10.1128 / JVI.77.2.1462-1468.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Ли Г, Дуан Т., Ву Х, Теш РБ, Сунг Л., Сяо С.-И. Инфекция вируса желтой лихорадки у сирийских золотых хомяков: взаимосвязь между экспрессией цитокинов и патологическими изменениями. Int J Clin Exp Pathol. (2008) 1: 169–79.
PubMed Аннотация | Google Scholar
61. Джуландер Дж. Г., Джа А. К., Чой Дж. А., Юнг К. Х., Сми Д. Ф., Морри Дж. Д. и др. Эффективность 2′-C-метилцитидина против вируса желтой лихорадки в культуре клеток и на модели хомяка. Antiviral Res. (2010) 86: 261–7. DOI: 10.1016 / j.antiviral.2010.03.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Джуландер Дж. Г., Фурута Ю., Шафер К., Сидвелл Р. В..Активность Т-1106 на модели хомячка вирусной инфекции желтой лихорадки. Противомикробные агенты Chemother. (2007) 51: 1962–6. DOI: 10.1128 / AAC.01494-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Джуландер Дж. Г., Морри Дж. Д., Блатт Л. М., Шафер К., Сидвелл Р. У. Сравнение ингибирующего действия интерферона альфакона-1 и рибавирина на инфицирование вирусом желтой лихорадки на модели хомяка. Antiviral Res. (2007) 73: 140–6. DOI: 10.1016 / j. антивирус.2006.08.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Джуландер Дж. Г., Бантиа С., Таубенхайм Б. Р., Миннинг Д. М., Котиан П., Морри Дж. Д. и др. BCX4430, новый аналог нуклеозидов, эффективно лечит желтую лихорадку на модели хомяка. Противомикробные агенты Chemother. (2014) 58: 6607–14. DOI: 10.1128 / AAC.03368-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Джуландер Дж., Эннис Дж., Тернер Дж., Морри Дж. Д.. Лечение вируса желтой лихорадки интерфероном, управляемым аденовирусом, DEF201, на модели хомяка. Противомикробные агенты Chemother. (2011) 55: 2067–73. DOI: 10.1128 / AAC.01635-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Джуландер Дж. Г., Трент Д. В., Монат ТП. Иммунные корреляты защиты от желтой лихорадки, определяемые пассивной иммунизацией и заражением на модели хомяка. Вакцина. (2011) 29: 6008–16. DOI: 10.1016 / j.vaccine.2011.06.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67.Сяо С.Ю., Гусман Х., да Роса А.П., Чжу Х.Б., Теш РБ. Изменение клинического исхода и гистопатологии инфекции вируса желтой лихорадки на модели хомяка в результате предшествующей инфекции гетерологичными флавивирусами. Am J Trop Med Hyg. (2003) 68: 695–703. DOI: 10.4269 / ajtmh.2003.68.695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Теш Р. Б., Травассос да Роса А. П., Гусман Х., Араужо Т. П., Сяо С.Ю. Иммунизация гетерологичными флавивирусами, защищающими от смертельного энцефалита Западного Нила. Emerg Infect Dis. (2002) 8: 245–51. DOI: 10.3201 / eid0803.010238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Базелер Л., де Вит Э, Скотт Д. П., Мюнстер В. Дж., Фельдманн Х. Сирийские хомяки ( Mesocricetus auratus ), ороназально инокулированные изолятом вируса Нипах из Бангладеш или Малайзии, развивают аналогичные поражения дыхательных путей. Vet Pathol. (2015) 52: 38–45. DOI: 10.1177 / 0300985814556189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.
